Лекция
Привет, Вы узнаете о том , что такое электролитическая диссоциация веществ, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое электролитическая диссоциация веществ , настоятельно рекомендую прочитать все из категории Неорганическая химия.
К началу XIX века естествоиспытатели установили, что все растворы можно разделить на две большие группы — непроводящие электрический ток и проводящие его. Немецкий физик Г. С. Ом выявил, что растворы-проводники проводят ток по тем же законам, что и металлы-проводники. Английский физик М. Фарадей изучил явление электролиза и установил его основные законы. Наблюдаемые в растворах явления и закономерности в 1887 году объяснил шведский ученый Сванте Аррениус, предложивший теорию электролитической диссоциации. Ее сущность можно выразить следующим образом:
электролиты распадаются на ионы в расплавах под действием высокой температуры, а в растворах вследствие взаимодействия с растворителем (рис. 56).

Процесс распада электролита на ионы называют электролитической диссоциацией.

Сванте Август
Аррениус —
шведский физико-
химик, автор теории
электролитической
диссоциации (1887 г.)
В твердом состоянии большинство ионных и молекулярных соединений — это диэлектрики, не проводящие ток. Так, электропроводность твердого NaCl в 1000 млрд раз меньше, чем у металлов или графита. В то же время водные растворы электролитов проводят ток вследствие того, что ионные и многие молекулярные соединения под влиянием полярных молекул воды при растворении распадаются (диссоциируют) на катионы и анионы.
Электролит — это вещество, которое проводит электрический ток вследствие диссоциации на катионы и анионы в расплаве или в растворе.
Электропроводность электролитов обусловлена подвижностью катионов и анионов в расплавах и растворах.
К электролитам относятся соли, щелочи, кислоты, то есть соединения с ионной или ковалентной полярной химической связью.
Ионные кристаллы состоят из катионов и анионов, связанных между собой силами электростатического взаимодействия в упорядоченную кристаллическую структуру. Под воздействием полярных молекул воды происходит разрушение ионных кристаллов и их растворение с образованием гидратов ионов (рис. 57).
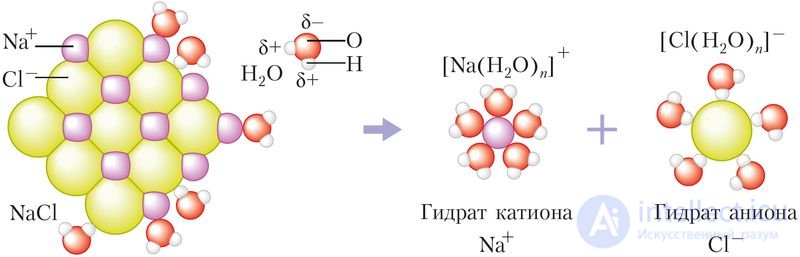
Изучите рисунок 57 и обратите внимание на относительный размер катионов Na+, анионов Cl–, молекул воды, а также знаки частичных зарядов на атомах H и O в молекуле воды. Обратите внимание на то, каким атомом молекула воды повернута к катиону Na+, а каким — к аниону Cl–. Почему молекула воды ориентирована к катиону Na+ атомом кислорода, а к аниону Cl– — атомом водорода?
Особенностью диссоциации ионных соединений (солей и щелочей) является то, что эти вещества уже состоят из ионов и полярные молекулы воды только разделяют катионы и анионы. Затрата энергии на диссоциацию компенсируется выделением энергии при гидратации ионов, и в целом процесс протекает самопроизвольно.
Являясь хорошо растворимыми в воде основаниями, щелочи диссоциируют в водных растворах на гидроксид-анионы и катионы металла:
В результате диссоциации солей в воде их ионные кристаллы распадаются на катионы металлов (или аммония) и анионы кислотных остатков:
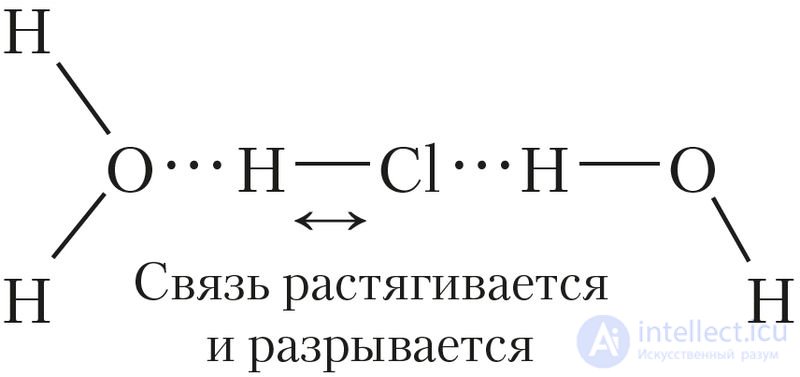
Большинство органических и неорганических кислот растворимы в воде и являются электролитами. В кислотах атомы водорода связаны ковалентными полярными связями с атомами кислотных остатков. В полярных молекулах готовых ионов нет. Рассмотрим процесс диссоциации кислот на примере молекулы .
Вначале полярные молекулы кислоты притягиваются к полярным молекулам воды и еще больше поляризуются.
Образуются водородные связи между молекулами кислоты и воды (рис. 58).
Затем ковалентная полярная связь удлиняется и становится менее прочной. В результате она разрывается, то есть происходит образование ионов:
Получившийся при диссоциации кислоты катион H+ присоединяется к молекуле воды с образованием катиона гидроксония H3O+ по донорно-акцепторному механизму, с которым вы познакомились, изучая материал § 13. Образовавшийся при ионизации ион хлора также оказывается гидратированным, что показано на рисунке 57.
Для упрощения уравнений реакций в ионной форме обычно записывают гидратированный катион водорода в виде Н+.
Аналогичным образом под действием полярных молекул воды происходит диссоциация и других соединений с ковалентным полярным типом связи.
Диссоциация включает процессы гидратации исходных молекул, их поляризации, разрушения связей в молекулах и их распада с образованием гидратированных ионов.
Молекулы кислот при диссоциации в водных растворах полностью или частично диссоциируют на катионы водорода и анионы кислотных остатков:
Атомы и молекулы являются электронейтральными частицами. Катионы металлов, например K+, как вам известно, образуются в результате того, что атомы металлов отдают электроны. Анионы неметаллов, например Br–, образуются в результате присоединения электронов к атомам неметаллов.
Свойства катионов и анионов отличаются от свойств соответствующих электронейтральных атомов. Так, в электрическом поле, которое создается электродами, происходит упорядоченное движение катионов и анионов электролита — электрический ток. Положительные ионы — катионы металлов, H+, и др. перемещаются к отрицательному электроду (катоду).
Отрицательные ионы — анионы кислотных остатков и OH– движутся к положительному электроду (аноду) (рис. 58.1).

В отличие от нейтральных атомов (в частности, атомов металлов) катионы, например Cu2+, Fe3+ и др., имеют меньшее число электронов на внешних электронных уровнях и меньший размер, всегда могут выступать в качестве окислителя и принимать электроны:
CuSO4 + Zn = ZnSO4 + Cu↓
или Cu2+ + Zn = Zn2+ + Cu↓.
В сравнении с нейтральными атомами (I, S, O) простые анионы, например, I–, S2– , O2– и др., имеют большее число электронов на внешних электронных уровнях и больший размер, могут выступать в качестве восстановителя и отдавать электроны:
2NaI + Cl2 = 2NaCl + I2
или 2I– + Cl2 = 2Cl– + I2.
Сильные и слабые электролиты
Одновременно с электролитической диссоциацией в растворе электролита протекают процессы ассоциации ионов. Поэтому в электролитах лишь определенная доля вещества существует в виде свободных ионов, то есть вещество может не полностью распадаться на ионы.
Для количественной характеристики электролитической диссоциации используют понятие степени диссоциации α.
Степень диссоциации α — это отношение числа молекул или формульных единиц электролита, распавшихся на ионы, к общему числу его растворенных молекул или формульных единиц:
.
Число частиц и их количество (моль) связаны между собой соотношением:
, следовательно,
,
где n — количество (моль) соответствующих молекул или формульных единиц.
Величину α выражают в долях единицы или процентах. Степень диссоциации показывает, какая часть электролита распалась и существует в растворе в виде свободных ионов. Например, степень диссоциации уксусной кислоты в растворе с молярной концентрацией 0,1 моль/дм3 равна 1,3 %. Это означает, что из 1000 молекул кислоты только 13 распались на катионы H+ и анионы CH3COO–.
Ассоциация ионов — объединение разноименных ионов под действием электростатических сил в нейтральные или заряженные частицы.
Примерами ассоциации могут быть необратимые реакции обмена (они будут рассмотрены в § 27), записанные в ионной форме:
Ag+ + Cl– = AgCl↓,
или обратимые реакции диссоциации слабых кислот:
.
Казалось бы, сильные кислоты в водных растворах полностью диссоциируют на ионы. Тем не менее смоченная водой лакмусовая бумага краснеет при помещении ее над 20–30%-ными растворами HCl и HNO3. Это свидетельствует о присутствии в растворе и парáх над раствором недиссоциированных молекул HCl и HNO3, которые диссоциируют, попадая на влажную бумагу. Однако уже над 5–10%-ными растворами этих сильных электролитов лакмусовая бумага не краснеет. Это свидетельствует о полной диссоциации молекул HCl и HNO3 на нелетучие ионы даже в таких сравнительно концентрированных растворах.
Можно оценить, насколько сильна диссоциация в водных растворах аммиака. Помещенная над разбавленным раствором аммиака влажная лакмусовая бумага окрашивается в синий цвет. Это объясняется тем, что бо́льшая часть аммиака в воде находится в молекулярном состоянии и улетучивается. Так, над 4%-ным раствором NH3 число молекул NH3 в полтора раза больше числа молекул паров воды.
Вероятность ассоциации ионов снижается при уменьшении концентрации электролита, а следовательно, степень диссоциации в разбавленных растворах больше, чем в концентрированных. Это означает, что степень диссоциации зависит не только от природы вещества, но и от концентрации электролита.
В зависимости от численного значения α электролиты условно делятся на сильные и слабые.
Сильные электролиты — это химические соединения, которые в разбавленных растворах практически полностью диссоциированы на ионы. Степень диссоциации α сильных электролитов близка к 1.
К сильным электролитам относятся растворимые ионные соединения и некоторые вещества с ковалентным полярным типом связи; в их случае практически отсутствует процесс ассоциации образовавшихся ионов. Поэтому в уравнениях, отражающих электролитическую диссоциацию, вместо знака равенства ставят стрелку в одном направлении. В качестве примеров приведем уравнения диссоциации растворимых солей (а), щелочей (б) и сильных кислот (в) — H2SO4, HCl, HBr, HI, HClO4, HNO3:
Степень диссоциации слабых электролитов составляет, как правило, менее 5 %. К слабым электролитам относится вода (), а также:
Слабые электролиты — химические соединения, которые даже в разбавленных растворах незначительно диссоциируют на ионы. Ионы слабых электролитов находятся в подвижном равновесии с молекулами, которые не продиссоциировали, или с веществом немолекулярного строения, которое не растворилось.
Диссоциацию слабых электролитов отображают уравнением распада со стрелками в двух направлениях: .
Провести четкую границу между сильными и слабыми кислотами довольно трудно. Принято считать слабой кислотой плавиковую (HF), хотя она в разбавленных растворах диссоциирует на 8–25 %. Фосфорную H3PO4, сернистую H2SO3 и щавелевую HOOC—COOH кислоты также считают слабыми. По первой ступени диссоциации они диссоциируют на 10–30 % в концентрированных растворах и более 50 % — в разбавленных.
Например, в разбавленном растворе H3PO4 диссоциирует согласно уравнению:
Степень диссоциации по этой ступени может достигать 50 %. На каждой последующей ступени степень диссоциации значительно уменьшается, а диссоциация протекает согласно уравнениям:
Уменьшение степени диссоциации связано с усилением взаимодействия ионов водорода c кислотными остатками в ряду
,
и
.
Степень диссоциации α обычно определяют экспериментальным путем по электропроводности раствора.
Диссоциация слабых электролитов как обратимая реакция подчиняется принципу Ле Шателье. Так, образующиеся на первой ступени диссоциации катионы H+ согласно принципу Ле Шателье сдвигают равновесие реакции диссоциации на второй и третьей ступени влево. Тем самым уменьшается степень диссоциации анионов и
и концентрация анионов
и
соответственно.
Как правило, на каждой последующей ступени степень диссоциации уменьшается.
В растворе H3PO4 с молярной концентрацией 1 моль/дм3 доли молекул H3PO4 и образовавшихся на разных стадиях анионов ,
и
составляют:
| H3PO4 | H+ | |||
| 92 % | ~8 % | ~8 % | ~6 · 10–6 % | ~10–16 % |
Все многоосновные слабые кислоты диссоциируют практически только по первой ступени. Рассмотрим еще один пример диссоциации слабой сероводородной кислоты. На первой ступени небольшая часть молекул H2S диссоциирует с образованием ионов водорода и гидросульфид-ионов, на второй — из гидросульфид-ионов образуются сульфид-ионы:
H2S H+ + HS–;
продолжение следует...
Часть 1 5.25. Электролитическая диссоциация веществ в растворах
Часть 2 Вопросы, задания, задачи - 5.25. Электролитическая диссоциация веществ в растворах
Часть 3 - 5.25. Электролитическая диссоциация веществ в растворах
Часть 4 - 5.25. Электролитическая диссоциация веществ в растворах
Часть 5 - 5.25. Электролитическая диссоциация веществ в растворах
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Неорганическая химия
Термины: Неорганическая химия