Лекция
Привет, Вы узнаете о том , что такое серная кислота, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое серная кислота , настоятельно рекомендую прочитать все из категории Неорганическая химия.

серная кислота Н2SO4 — важнейшая из минеральных кислот.
Это вещество молекулярного строения. Из структурной формулы видно, что серная кислота является гидроксидом и относится к двухосновным кислотам (рис. 83).
Промышленное получение серной кислоты — многостадийный процесс, сырье для него — это пирит (железный или серный колчедан) FeS2 и другие сульфидные руды, сера S, сероводород H2S (из нефти), отходы металлургического производства. Схема получения кислоты из пирита выглядит так:
Как видно, процесс включает три стадии, выражаемые следующими уравнениями реакций:
На третьей стадии оксид серы(VI) SO3 в поглотительной башне орошается концентрированной серной кислотой с массовой долей кислоты 96–98 % (то есть содержание воды всего 2–4 %). При этом получают раствор оксида серы(VI) в серной кислоте (олеум). Воду для поглощения SO3 не используют, так как из-за выделения большого количества теплоты образуется «сернокислотный туман», который трудно сконденсировать.
Мировое производство серной кислоты — около 200 млн тонн в год. Самый крупный потребитель серной кислоты — производство минеральных удобрений. Кроме того, она используется для получения различных минеральных кислот и солей, химических волокон, красителей, взрывчатых веществ, в промышленном органическом синтезе, в нефтяной, металлообрабатывающей, текстильной, кожевенной, пищевой и других отраслях промышленности (рис. 84), как электролит в свинцовых аккумуляторах (рис. 85).


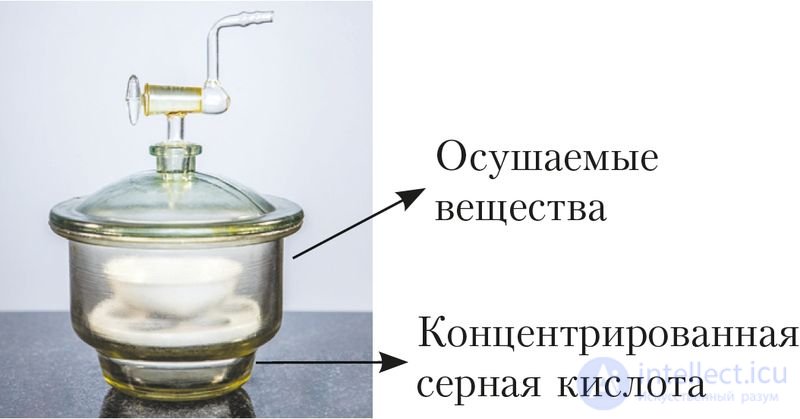
Серная кислота — тяжелая бесцветная маслянистая жидкость, с температурой плавления 10,4 °С, плотностью 1,84 г/см3. Она смешивается с водой в любых соотношениях. При растворении кислоты в воде выделяется значительное количество теплоты, что является свидетельством образования прочных гидратов. По этой причине серная кислота — сильное водоотнимающее средство, ее используют для осушения различных веществ, в том числе и газов (рис. 86).
Важно помнить: при разбавлении кислоту медленно льют в воду, чтобы тяжелые струйки кислоты опускались на дно сосуда. Это необходимо для предотвращения разбрызгивания жидкости в результате сильного повышения температуры.
При попадании на кожу серная кислота вызывает тяжелые ожоги, ее пары поражают слизистые оболочки и легкие.
Свойства разбавленной и концентрированной серной кислот существенно различаются.
Химические свойства разбавленной серной кислоты. Разбавленная серная кислота — сильный электролит, она проявляет общие свойства кислот: меняет цвет индикаторов и образует соли в реакциях с металлами, основными и амфотерными оксидами, гидроксидами металлов, другими солями. Рассмотрим конкретные примеры.
1. Индикаторы лакмус и метилоранж окрашивают раствор серной кислоты в красный цвет. В разбавленных растворах серная кислота диссоциирует согласно схеме:
2. Образование солей:
а) металлы, расположенные в ряду активности до водорода, вытесняют его из разбавленных растворов серной кислоты:
Zn + Н2SO4 = ZnSO4 + H2↑;
Fe + Н2SO4 = FeSO4 + H2↑;
б) реакции серной кислоты с основными и амфотерными оксидами, как правило, требуют небольшого нагревания для увеличения скорости:
СuO + Н2SO4 = CuSO4 + H2O;
Al2O3 + 3Н2SO4 = Al2(SO4)3 + 3H2O;
в) в реакциях со щелочами и нерастворимыми основаниями образуются соли и вода (нейтрализация):
2NaOH + Н2SO4 = Na2SO4 + 2H2O или NaOH + Н2SO4 = NaНSO4 + H2O;
Сa(OH)2 + Н2SO4 = СаSO4↓ + 2H2O.
Отметим, что при мольном соотношении щелочи NaOH и кислоты Н2SO4 2 : 1 или избытке NaOH образуется средняя соль (сульфат), а при их соотношении 1 : 1 — кислая соль (гидросульфат). Об этом говорит сайт https://intellect.icu . Следовательно, избыток многоосновной (двухосновной) кислоты Н2SO4 приводит к образованию кислых солей;
г) реакции растворов серной кислоты с солями протекают в полном соответствии с условиями реакций ионного обмена:
H2SO4 + Na2CO3 = Na2SO4 + H2O + CO2↑;
H2SO4 + Na2SiO3 = Na2SO4 + H2SiO3↓.
Химические свойства концентрированной серной кислоты. В сильно концентрированных растворах диссоциация серной кислоты протекает лишь по первой ступени: . Концентрированная серная кислота — более сильный окислитель, чем разбавленная. Ее окислительные свойства проявляются прежде всего в реакциях с металлами. Отметим несколько важных моментов.
Во-первых, происходит восстановление не водорода, а атомов серы. Продуктами восстановления являются SO2, S и Н2S. Состав преимущественно образующихся продуктов зависит как от концентрации кислоты, так и от активности металла как восстановителя. Чем меньше концентрация кислоты и выше активность металла, тем сильнее восстанавливаются атомы серы. В общем виде взаимодействие концентрированной серной кислоты с металлами можно представить схемой:

Так, в реакции с металлами, находящимися в ряду активности после водорода (кроме золота и платины), образуется оксид серы(IV) SO2, например:
В реакциях с металлами, расположенными в ряду активности до водорода, могут образовываться и SO2, и S, и Н2S. Например, cхемы реакций, протекающих при взаимодействии цинка с серной кислотой по мере увеличения ее концентрации, выглядят так:
Во-вторых, некоторые сравнительно активные металлы (например, железо, алюминий, хром) концентрированной серной кислотой при комнатной температуре пассивируются: на поверхности металла образуется плотная оксидная пленка. Благодаря пассивации железа возможна перевозка кислоты в стальных цистернах.
Среди других особенностей концентрированной серной кислоты можно отметить следующие. Она способна вытеснять менее сильные или более летучие кислоты (НСl, HNO3, H3PO4, CH3COOH) из их солей:
Концентрированная кислота окисляет сложные органические вещества: обугливает бумагу, древесину, кожу, поэтому необходимо крайне осторожное обращение.
Из-за особенности концентрированной серной кислоты образовывать гидраты H2SO4 · nH2O ее широко используют как сильное водоотнимающее средство, а также как катализатор в органическом синтезе.

Применение концентрированной серной кислоты как водоотнимающего средства и катализатора в органическом синтезе демонстрируют уравнения реакций:
Серная кислота, как было отмечено выше, образует два ряда солей — гидросульфаты (кислые) и сульфаты (средние), большинство из которых хорошо растворимы. В твердом виде из кислых солей выделены соли лишь активных металлов (КНSO4, NaHSO4 и др.). Средние соли часто образуют кристаллогидраты (Na2SO4 · 10H2O, CuSO4 · 5H2O и др.), поэтому безводные соли (сульфат натрия, сульфат магния) используют в лабораторной практике в качестве осушителей. Сульфаты щелочных металлов имеют достаточно высокую термическую устойчивость.
Для идентификации (качественного обнаружения) сульфат-ионов чаще всего используют растворимые соли бария (ВаСl2 или Ва(NO3)2). При этом образуется белый осадок сульфата бария (Приложение 3):
Многие сульфаты являются веществами крупнотоннажного производства (табл. 28).
Таблица 28. Применение сульфатов
| Химическая формула и название | Области использования | |
Na2SO4 · 10H2O глауберова соль (мирабилит) |
 |
Производство синтетических моющих средств, целлюлозы, стекольное производство, текстильная промышленность |
MgSO4 · 7H2O горькая (английская) соль |
 |
Медицина — для снижения давления при внутривенном введении; слабительное средство. Микроудобрение. Сушка растворителей в лабораторной практике безводным сульфатом магния |
CuSO4 · 5H2O медный купорос |
 |
Медицина и растениеводство — антисептик. В составе бордосской смеси как фунгицид |
FeSO4 · 7Н2О железный купорос |
 |
Сельское хозяйство — фунгицид, деревообрабатывающая промышленность — антисептик для пропитки древесины. Производство минеральных красок |
* ZnSO4 · 7Н2О цинковый купорос |
 |
Обладает высоким противомикробным и бактерицидным действием. Находит применение в медицине (мази, глазные капли и др.) и аграрном секторе (повышение урожайности, нормализация иммунной системы животных) |
Разбавленная серная кислота — сильный электролит, проявляет общие свойства кислот. Концентрированная серная кислота — сильный окислитель.
Серная кислота как двухосновная образует два ряда солей — гидросульфаты (кислые) и сульфаты (средние).
При взаимодействии разбавленной серной кислоты с металлами образуются соль и водород, а концентрированной — соль, вода и продукты восстановления серы — SO2, S и Н2S.
Для качественного обнаружения сульфат-ионов используют растворы хлорида или нитрата бария.
В основе промышленного получения серной кислоты из пирита лежат реакции, осуществляемые в соответствии со схемой:
FeS2 → SO2 → SO3 → H2SO4.
1. Запишите молекулярную и структурную формулы серной кислоты. Назовите области ее применения.
2. Из текста параграфа выпишите формулы:
Назовите их.
3. Составьте формулы веществ:
4. Из перечня Mg, Zn, Al, Ag, Fe, Cr, Sn, Cu, Au, Рt выпишите символы металлов, которые:
5. Составьте уравнения реакций образования кислых и средних солей при взаимодействии гидроксидов натрия и кальция с:
Назовите образующиеся соли.
6. Оксид серы(VI) массой 8 г растворили в воде массой 132 г. Определите массовую долю кислоты в растворе.
7. Расставьте коэффициенты методом электронного баланса в уравнениях реакций, протекающих при взаимодействии цинка с концентрированной серной кислотой разной концентрации, согласно схемам на с. 193, 194.
8. Вторая стадия производства серной кислоты из пирита — окисление оксида серы(IV) в оксид серы(VI) основана на обратимой каталитической реакции:
В условиях производства SO3 является газом. Укажите условия смещения равновесия в сторону продукта реакции.
9. Определите массу раствора серной кислоты с массовой долей 20 %, который можно получить при разбавлении раствора объемом 1 дм3 (плотность 1,835 г/см3) с массовой долей серной кислоты 96 %.
10. Имеется 500 г раствора оксида серы(VI) в серной кислоте. Массовые доли H2SO4 и SO3 составляют 92 % и 8 % соответственно. Сколько граммов воды нужно добавить для получения 100%-ной серной кислоты?
1. Укажите признаки, характерные для серной кислоты:
2. Глауберова соль имеет состав:
3. Белый осадок выпадает при взаимодействии хлорида бария с водными растворами:
4. Процесс обжига серного колчедана иллюстрирует схема:
5. С металлом реагирует концентрированная серная кислота, если продуктами реакции являются:
Исследование, описанное в статье про серная кислота, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое серная кислота и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Неорганическая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Неорганическая химия
Термины: Неорганическая химия