Лекция
Привет, Вы узнаете о том , что такое строение атома, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое строение атома , настоятельно рекомендую прочитать все из категории Неорганическая химия.
Изучая материал второй главы, вы углубите знания о составе атомного ядра и явлении радиоактивности, о состоянии электронов в атоме, расширите представления об атомной орбитали, энергетических уровнях и подуровнях. Освоение этого материала позволит вам объяснять и характеризовать закономерности изменения свойств атомов химических элементов и образуемых ими веществ по группам и периодам периодической системы.
Важнейшие понятия темы: относительная атомная масса, изотопы, радиоактивность, орбиталь, энергетический уровень, подуровень, формула электронной конфигурации, электронно-графическая схема, радиус атома, электроотрицательность, амфотерность, периодическая система химических элементов (период, группа).
Одно из наиболее ранних утверждений об атомах как неделимых частицах вещества содержится в трудах древнегреческого ученого Демокрита (V–IV вв. до н. э.). Лишь в конце XIX века благодаря ряду научных открытий в области физики стало понятно, что атом имеет сложное строение.
В 1911 году Э. Резерфорд на основании экспериментальных данных предложил ядерную (планетарную) модель строения атома. В этой модели атом рассматривался как своеобразная «солнечная система», в центре которой находится положительно заряженное ядро, а вокруг ядра по своим орбитам движутся электроны.
Дальнейшие исследования физиков показали, что ядра атомов состоят из протонов и нейтронов. Нейтрон не имеет заряда, а протон несет положительный заряд, равный величине заряда электрона. Число протонов в ядре определяет его заряд по абсолютной величине и порядковый номер элемента (рис. 11).
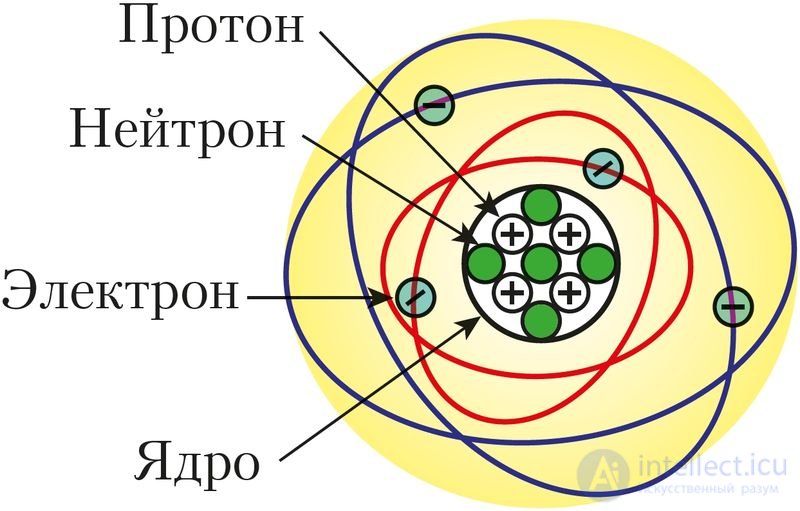
Рис. 11. Планетарная модель
атома бериллия

Доказательствами сложного строения атома послужили открытия фотоэффекта (А. Г. Столетов, 1889), радиоактивности (А. Беккерель, М. Склодовская-Кюри, 1896–1899 гг.), катодных лучей (Дж. Томсон, 1897), эксперименты по определению природы α-частиц (Э. Резерфорд, 1899–1900).
Исследования природы частиц, входящих в состав атомов, были дополнены представлениями квантовой механики, развивавшимися М. Планком А. Эйнштейном, Н. Бором, Луи де Бройлем, В. Гейзенбергом, Э. Шредингером.
Если заряд электрона, равный 1,6 ∙ 10–19 Кл, принять за 1, то заряд ядра любого атома будет численно равен порядковому номеру Z соответствующего химического элемента или числу протонов в ядре. В таком случае заряд ядра выражен в единицах элементарного заряда. Это безразмерная величина, как и относительная атомная масса. Например, уран — химический элемент с порядковым номером 92. Заряд его ядра в относительных единицах равен 92.
Суммарное число протонов (Z) и нейтронов (N) в ядре называется массовым числом (А):
A = Z + N.
Массовое число А имеет только целочисленные значения.
Атом в свободном состоянии является электронейтральной частицей. Следовательно, число протонов в ядре атома равно числу электронов. Важнейшие характеристики протонов, нейтронов и электронов приведены в таблице 4.
Таблица 4. Важнейшие характеристики протонов, нейтронов, электронов
| Характеристики | Ядро | Оболочка | |
| Протон | Нейтрон | Электрон | |
| Символ | p | n | e– |
| Масса, кг | ≈ 1,673 ∙ 10–27 | ≈ 1,675 ∙ 10–27 | ≈ 9,109 ∙ 10–31 |
| Масса, а. е. м. | 1,0073 ≈ 1 | 1,0087 ≈ 1 | 0,0005 ≈ 0 |
| Электрический заряд, Кл | ≈ 1,602 ∙ 10–19 | 0 | ≈ –1,602 ∙ 10–19 |
| Электрический заряд в единицах элементарного заряда | +1 | 0 | –1 |
| Обозначение в уравнениях ядерных реакций | |||
Массу ядра (mz) можно приблизительно определить, суммировав массы всех протонов (Zmp) и нейтронов (Nmn), из которых оно состоит.
Точное значение массы ядра немного меньше этой суммы:
mz < Zmp + Nmn.
Например, масса ядра нуклида кислород-16 равна 15,995. Об этом говорит сайт https://intellect.icu . Разница объясняется выделением колоссальной энергии при образовании ядра из протонов и нейтронов. Именно из-за выделения этой энергии, называемой энергией связи (∆E), происходит потеря общей массы. Энергия связи в ядре в миллионы раз превышает прочность химической связи, поэтому ядра атомов в химических реакциях не разрушаются.

В курсе физики 11-го класса вы научитесь рассчитывать «дефект масс» и энергию связи, исходя из равенства , где с — скорость света в вакууме.
При образовании из протонов и нейтронов 1 моль атомов гелия, в ядрах которых содержится по два протона и по два нейтрона, выделяется 2,73 · 1012 Дж энергии. Для сравнения: при образовании очень прочной тройной химической связи в молекуле азота выделяется энергия 9,45 · 105 Дж/моль, то есть почти в 3 миллиона раз меньше.
Число нейтронов в ядрах атомов одного и того же химического элемента может варьироваться в небольших пределах.
Длительное время считали, что химический элемент — это вид атомов с определенной массой. Однако в 1913 году было установлено, что у одного и того же химического элемента могут быть атомы, различающиеся по массе. Такие разновидности атомов назвали изотопами.
Изотопы — это атомы, относящиеся к одному химическому элементу, но отличающиеся по массе. Их ядра состоят из одинакового числа протонов, но разного числа нейтронов.
Кроме понятия изотопа существует понятие нуклид.
Вид атомов с определенным количеством протонов и нейтронов в ядре называют нуклидом (от лат. nucleus — ядро). Совокупность атомов, в ядрах которых содержится одинаковое число протонов, относят к одному химическому элементу, то есть все атомы одного химического элемента имеют одинаковый заряд ядра.
Нуклиды принято обозначать , где Э — символ химического элемента, Z — число протонов в ядре (атомный номер элемента), A — массовое число, равное суммарному числу протонов и нейтронов в ядре. Например,
,
,
.
Большинство химических элементов в природе существует в виде нескольких нуклидов. Так, у кремния три стабильных нуклида, а у олова их десять.

В настоящее время для 118 элементов известно более 3400 нуклидов.
Например, существующие в природе нуклиды ,
и
— изотопы водорода, так как принадлежат одному и тому же химическому элементу, но различаются числом нейтронов в ядре атома (рис. 12). Их называют водород-1, или протий (H), водород-2, или дейтерий (D), водород-3, или тритий (T). Массы атомов водорода-1, водорода-2 и водорода-3 равны 1,008, 2,014 и 3,016 а. е. м., или приблизительно 1, 2 и 3 а. е. м.
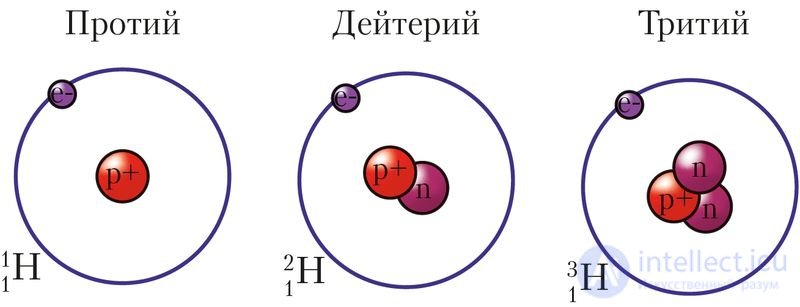
Рис. 12. Схема строения изотопов водорода
Вещества, содержащие различные изотопы, практически не отличаются химическими свойствами, но имеют различия в некоторых физических свойствах. Например, вода H2O, в состав молекул которой входит протий, замерзает при 0 °С. В то же время вода, состоящая из молекул D2O, замерзает при 3,81 °С, а из молекул T2O — при 4,48 °С.
Значение атомных масс изотопов и их относительное содержание определяют методом масс-спектроскопии. Именно с учетом значений атомных масс изотопов и их доли в природе вычисляют относительную атомную массу химических элементов.
Уточним определение, приведенное ранее на с. 7. Относительная атомная масса химического элемента — физическая величина, равная отношению усредненной массы атомов элемента к части массы атома углерода-12 (12С). Теперь становится понятным, что подразумевается под термином «усредненная масса» атомов элемента. Ее можно рассчитать, имея сведения о точном значении массы и распространенности изотопов элемента. Покажем этот расчет на следующем примере.
Пример 1. Известно, что химический элемент кислород в природе представлен тремя изотопами: ,
и
. Их относительные атомные массы соответственно равны 15,995, 16,999 и 17,999. В изотопной смеси на долю атомов кислорода-16 приходится 99,757 %, кислорода-17 — 0,038 %, а кислорода-18 — 0,205 %. Рассчитайте относительную атомную массу элемента кислорода.
Решение. Для наглядности расчета выделим 100 000 атомов этой изотопной смеси. Тогда в ней будет 99 757 атомов кислорода-16, всего лишь 38 атомов кислорода-17 и 205 атомов кислорода-18. Для определения среднего значения относительной атомной массы кислорода, очевидно, надо сложить массы всех атомов и разделить на число этих атомов:
Полученное значение совпадает с тем, что приведено в периодической системе.
Относительная атомная масса химического элемента — это усредненное значение относительных атомных масс его изотопов с учетом их распространенности.
Следует помнить, что каждому нуклиду присуще определенное массовое число. Нельзя говорить о массовом числе химического элемента, так как в природе у одного и того же химического элемента может быть несколько изотопов.
Небольшие различия физических свойств веществ, включающих разные изотопы одного и того же элемента, приводят к тому, что изотопный состав вещества зависит от способа его получения и существования. Например, сахароза свекловичного сахара содержит меньше нуклида 13C, чем сахароза, выделенная из сахарного тростника. Такие различия нередко позволяют определить происхождение вещества. Сведения об изотопном составе веществ используются в геологии, медицинской диагностике, криминалистике, для контроля состояния окружающей среды.

В природе 21 химический элемент существует в виде лишь одного стабильного нуклида. К ним относятся Be, F, Na, Al, P, Sc, Mn, Co, As, Y, Nb, Rh, I, Cs, Pr, Tb, Ho, Tm, Au, Bi, Pa. Их относительные атомные массы в периодической системе указаны с точностью, значительно большей, чем для элементов, существующих в виде смеси изотопов.
Ядра атомов состоят из протонов и нейтронов. Относительный заряд ядра определяется числом содержащихся в нем протонов и равен порядковому номеру соответствующего химического элемента.
Изотопы — это атомы одного и того же химического элемента, ядра которых состоят из одинакового числа протонов, но разного числа нейтронов.
Относительная атомная масса химического элемента — это усредненное значение относительных атомных масс его изотопов с учетом распространенности изотопов элемента.
Вопросы, задания, задачи
1. Назовите:
2. Приведите обозначения нуклидов хлор-35 и хлор-37, йод-127 и йод-131 в виде .
3. Используя данные таблицы 4, сравните характеристики:
4. Ответьте на вопросы:
5. Определите число протонов и нейтронов в ядрах изотопов углерода с массовыми числами 12, 13 и 14.
6. Укажите число электронов в следующих атомах и ионах: H–, H+, He, Au, Cа2+.
7. Определите, сколько разновидностей молекул воды может образоваться из кислорода и водорода, если имеется смесь атомов водорода и кислорода, включающая нуклиды: ,
,
,
,
.
8. Сопоставьте состав нуклидов 40Ar, 40K, 40Ca, а также 3H, 3He и 14С, 14N. Можно ли однозначно установить принадлежность атома к определенному элементу только на основании величины его массового числа?
9. Рассчитайте относительную атомную массу природной меди, если известно, что она состоит из двух изотопов 63Cu (69 %) и 65Cu (31 %), причем Аr(63Cu) = 62,93, Аr(65Cu) = 64,93. Ответ проверьте по периодической системе Менделеева.
10. Известно, что химический элемент углерод в природе представлен двумя стабильными изотопами углерод-12 и углерод-13, относительные атомные массы которых соответственно равны 12,000000 и 13,003355. На долю атомов углерода-12 приходится 98,90 %, а на долю атомов углерода-13 — 1,10 %. Рассчитайте относительную атомную массу углерода и сопоставьте полученное значение с тем, что приведено в периодической системе.
*Самоконтроль
1. Число протонов в ядре атома равно:
2. Изотопам углерода соответствуют записи:
3. В записи число 27 является:
4. Одинаковое число нуклонов (нуклоны — протоны и нейтроны) содержат нуклиды:
5. Ядро нуклида содержит:
Исследование, описанное в статье про строение атома, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое строение атома и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Неорганическая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Неорганическая химия
Термины: Неорганическая химия