Лекция
Привет, Вы узнаете о том , что такое 1.1. Химия. Вещество, химический элемент, атом, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое 1.1. Химия. Вещество, химический элемент, атом , настоятельно рекомендую прочитать все из категории Неорганическая химия.
В параграфе приведены ранее изученные понятия и определения: что такое химия, вещество, его физические свойства, химический элемент, атом, его масса, размер, ионы, молекулы, а также даны напоминания о том, как рассчитать массовую долю вещества в смеси и объемную долю газа в смеси. Этот материал приведен для повторения в систематизированном виде.
Химия — наука, изучающая вещества, их состав, строение, свойства, химические превращения одних веществ в другие.
Химию как науку подразделяют на ряд отраслей: неорганическую, органическую, биоорганическую, аналитическую, физическую, фармацевтическую химию, нанохимию и др. Различие в отраслях определяется природой изучаемых веществ и их превращений, а также характером решаемых задач.
Подчеркивая специфику своих исследований, химики ввели понятие «химическое вещество», хотя это словосочетание часто упрощают и называют просто «вещество».
Химическое вещество — это устойчивая система частиц (атомов, ионов или молекул), обладающая определенными физическими и химическими свойствами.
Качественный и количественный состав индивидуальных химических веществ записывают в виде химических формул, например: H2O — вода, CuSO4 — сульфат меди, N2 — азот, Na — натрий, NaCl — хлорид натрия.
Химическая формула — это условная запись состава веществ с помощью символов химических элементов и числовых индексов.
К физическим свойствам вещества относят цвет, плотность, твердость, температуры плавления и кипения и другие характеристики, которые, как правило, выражаются измеряемыми величинами. Так, йод можно охарактеризовать следующим образом: кристаллическое при комнатной температуре вещество темно-фиолетового цвета с металлическим блеском, мало растворимое в воде, температура его кипения равна 184,4 °С, плавления — 113,5 °С, плотность составляет 4,9 г/cм3.
Химические свойства веществ — это их способность превращаться в другие вещества под воздействием температуры, давления, излучения или других веществ.
Так, карбонат кальция под воздействием температуры (а не других веществ) превращается в оксид кальция и углекислый газ:
а оксид меди(II), вступая во взаимодействие с серной кислотой, образует соль — cульфат меди(II):
Атом — это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Совокупность атомов с одинаковым зарядом ядра называют химическим элементом.
Символы химических элементов приведены в периодической системе химических элементов Д. И. Менделеева. Как вам известно, порядковый (атомный) номер химического элемента в периодической системе Д. И. Менделеева соответствует относительному заряду ядра (Z). Так, порядковый номер 8 соответствует относительному заряду ядра атома кислорода +8, а ядро с относительным зарядом +13 имеет атом алюминия.
Атомы разных химических элементов отличаются не только зарядом ядра, но и массой, размером, строением.
Масса атома (ma), как и масса других объектов, может выражаться в единицах массы системы СИ — килограммах, например:
Гораздо удобнее пользоваться шкалой относительных единиц. Для характеристики массы атомов и других микрочастиц в химии используют атомную единицу массы — 1 а. е. м., равную части массы атома углерода-12. Вместо русского обозначения атомной единицы массы (1 а. е. м.) часто приводят ее международное обозначение 1 u (unit). Масса 1 u составляет:
Сравнивая массы атомов с 1 u, получают безразмерную величину, которую называют относительной атомной массой и обозначают символом Ar (где r — начальная буква латинского слова relativus — относительный):
Относительная атомная масса элемента — физическая величина, которая равна отношению усредненной массы атомов данного элемента к части массы атома углерода-12 (12С).
Относительные атомные массы используют в химии при проведении расчетов и сопоставлений; их значения приведены в периодической системе химических элементов. Для расчета массы атомов или их относительных атомных масс можно воспользоваться формулами:
Размер атома часто характеризуют величиной «радиус атома» (ra). Это величины порядка десятых и сотых долей нанометра. Так, радиус наименьшего по размерам атома гелия равен 3 ∙ 10–11 м, или 0,03 нм.
Строение атомов определяет состав и свойства образуемых ими веществ, что будет подробно рассматриваться в главах II и III.
При образовании химического вещества как устойчивой системы частиц атомы могут отдавать или присоединять электроны, превращаясь в ионы. При отдаче электронов образуются положительно заряженные частицы — катионы, при присоединении электронов получаются отрицательно заряженные частицы — анионы. Ряд химических веществ состоит из катионов и анионов, объединенных силами кулоновского взаимодействия.
Атомы могут объединяться в устойчивые системы также путем обобществления электронов с соседними атомами с образованием незаряженных частиц — молекул, способных проявлять химические свойства всего вещества. Подробнее материал о веществах молекулярного строения описан в следующем параграфе, а сведения о строении веществ представлены в главе III.
Важно понимать, что только устойчивая система атомов, или ионов, или молекул является химическим веществом, то есть обладает и физическими, и химическими свойствами. Для одной частицы, например молекулы йода, сульфид-иона или атома углерода, не имеет смысла вести речь о температуре кипения, плавления или агрегатном состоянии.
Для каждого вещества характерен свой набор свойств. Об этом говорит сайт https://intellect.icu . Даже малое количество примеси может существенно изменить эти свойства. В природе вещества обычно находятся в смеси с другими веществами. Поэтому для практического использования или проведения исследований вещества необходимо получить его в чистом виде, то есть выделить из смеси, очистить от примесей. С этой целью как в лабораторной практике, так и в производственных условиях используют различные методы разделения смесей веществ и их очистки. Они основаны на различии свойств разделяемых веществ: разные температуры плавления или кипения, плотность, растворимость и др. Наиболее распространены такие методы очистки, как фильтрование (рис. 1), отстаивание (рис. 2), перекристаллизация, перегонка (рис. 3). Выделить вещество из раствора можно выпариванием (рис. 4), а разделить смесь жидких веществ — ректификацией (рис. 5).

Для разделения газов могут быть использованы «молекулярные сита», например кристаллические алюмосиликаты, характеризующиеся точным и однородным размером пор. Поры пропускают небольшие молекулы, но задерживают более крупные. Для восстановления активности «молекулярных сит» их необходимо прогреть или продуть газом.
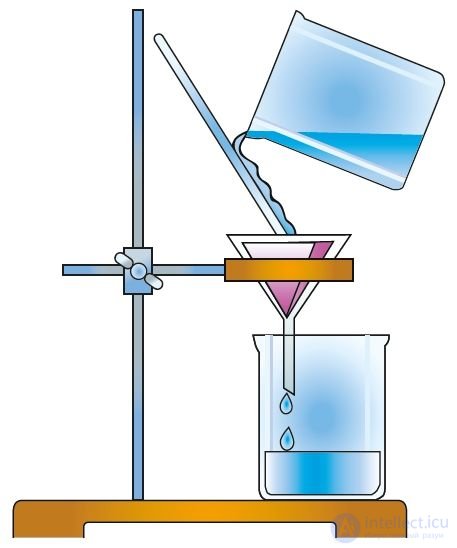
Рис. 1. Фильтрование
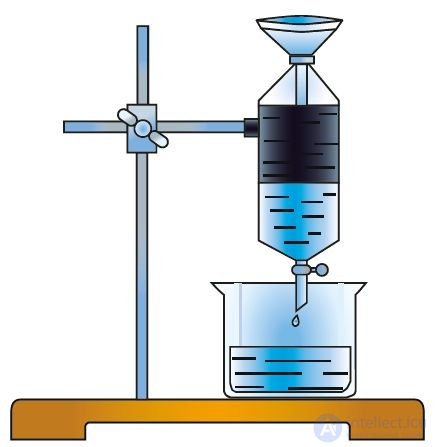
Рис. 2. Отстаивание
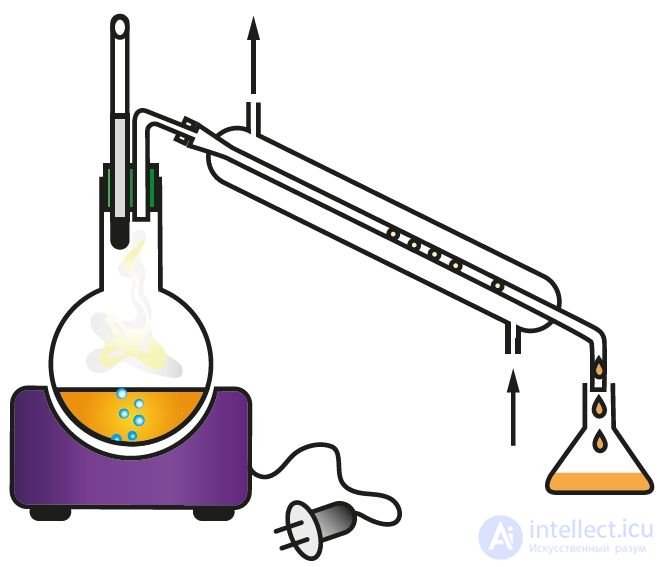
Рис. 3. Перегонка жидкости
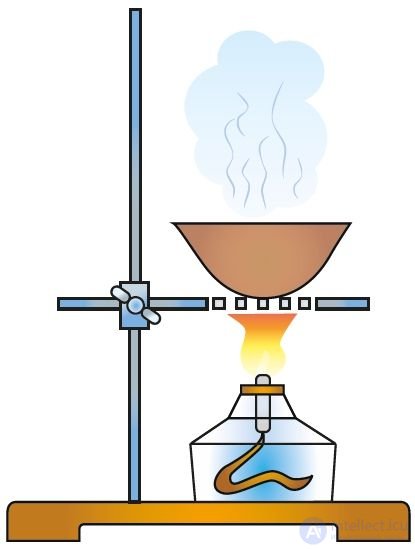
Рис. 4. Выпаривание
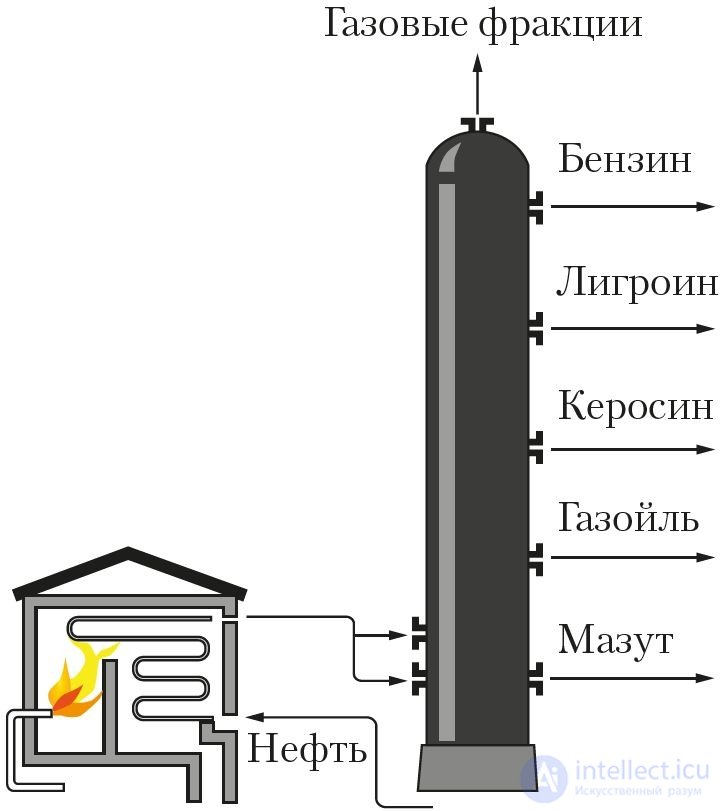
Рис. 5. Разделение нефти на фракции в ректификационной колонне
Содержание вещества в смеси можно характеризовать массовой и объемной долями.
Массовую долю вещества рассчитывают как отношение массы вещества к массе всей смеси:
Массовая доля вещества — безразмерная величина. Чаще ее выражают в процентах. Для этого полученную безразмерную величину умножают на 100.
Так, массовой долей характеризуют содержание основных компонентов в продуктах питания, примесей в химических реактивах, горных породах, удобрениях, действующего вещества в медицинских препаратах и т. д. Например, массовая доля жиров в молоке составляет от 1 до 6 %, в сливочном масле — 50–82,5 %, уксусной кислоты в уксусе — 3–9 %, йода в спиртовом растворе — 5 %. Следует отметить, что массовая доля не зависит от величины порции смеси, она определяется лишь соотношением компонентов смеси.
Объемная доля газа в смеси. Смеси образуют не только твердые или жидкие вещества, но и газы, поэтому для газов часто рассчитывают объемную долю как отношение объема газа к общему объему смеси:
Так, содержание кислорода по объему в воздухе равно 21 %, то есть его объемная доля φ(О2) = 21 % (при этом его массовая доля равна 23 %).
Абсолютно чистых веществ не бывает. Степень чистоты веществ количественно оценивают массовой долей — отношением массы основного вещества (идеально чистого) к массе реального вещества с примесями.
Пример 1. Анализ пробы золотого банковского слитка массой 1,00000 г показал, что в нем содержится 0,99994 г чистого золота. Это означает, что степень чистоты такого золота составляет:
Остальные 0,006 % в этом слитке приходятся на различные примеси (другие вещества).
Выбор веществ по чистоте определяется целями их применения. Например, требуемая чистота германия, используемого в полупроводниковых устройствах, должна составлять 99,99999999 %.
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Химический элемент — это совокупность атомов с одинаковым положительным зарядом ядер. Атомы разных химических элементов отличаются зарядом ядер, массой, размерами и строением.
Относительная атомная масса элемента — физическая величина, которая равна отношению усредненной массы атомов данного элемента к части массы атома углерода-12 (12С).
Химическое вещество — устойчивая система частиц (атомов, ионов или молекул), обладающая определенными физическими и химическими свойствами.
Вопросы, задания, задачи
1. Запишите названия и символы химических элементов, имеющих:
2. Выпишите выражения, характеризующие массу атома кислорода:
3. Предложите способы:
4. Объясните, какие характеристики относятся к химическому веществу, а какие к химическому элементу:
5. Масса атома некоторого элемента равна:
Определите его относительную атомную массу.
6. В каком объеме воздуха содержится 10 г кислорода?
7. Чему равна массовая доля алюминия в железоалюминиевой термитной смеси, приготовленной из алюминия массой 5 кг и оксида железа(III) массой 15 кг? Термитная смесь такого состава используется для сварки рельсов.
8. Мозырский нефтеперерабатывающий завод рассчитан на переработку 12 млн тонн нефти в год. Рассчитайте массу дизельного топлива, которое может быть выработано на заводе за 1 месяц, если считать, что массовая доля такого вида топлива составляет около 32 % от переработанной нефти.
9. Нефтеперегонный завод-гигант может за год переработать до 25 млн тонн нефти. В процессе перегонки нефти потери составляют около 1 %. Оцените годовые потери при перегонке нефти по массе и объему на таком заводе (примите среднюю плотность нефти 0,9 г/см3).
10. Рассчитайте число атомов в прямоугольной алюминиевой пластинке длиной 5 см, шириной 3 см и толщиной 1 мм. Плотность алюминия — 2,7 г/см3. Предложите два способа решения.
*Самоконтроль
1. Число известных химических элементов составляет:
2. Каждое химическое вещество характеризуется:
3. Физические свойства железа характеризуют утверждения:
4. К процессам разделения веществ не относится:
5. В смеси газов, содержащей 1 дм3 СО, 4 дм3 Н2, 1 дм3 СН4, 3 дм3 СО2, объемная доля водорода равна:
г) 44 %.
Исследование, описанное в статье про 1.1. Химия. Вещество, химический элемент, атом, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое 1.1. Химия. Вещество, химический элемент, атом и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Неорганическая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Неорганическая химия
Термины: Неорганическая химия