Лекция
Привет, Вы узнаете о том , что такое 45.1. Получение металлов электролизом водных растворов солей, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое 45.1. Получение металлов электролизом водных растворов солей , настоятельно рекомендую прочитать все из категории Неорганическая химия.
В § 45 вы познакомились с электрохимическим методом промышленного получения металлов, который основан на электролизе, — электрометаллургией.
У этого метода есть две разновидности. Первая — это проведение электролиза расплава соединений металлов. Особенности этого способа вы рассмотрели на примере электролиза расплава хлорида магния.
Вторая разновидность электрохимического метода, называемая гидроэлектрометаллургией, основана на электролизе водных растворов солей металлов. Преимущество этого метода, по сравнению с электролизом расплавов, заключается в том, что он не требует энергетических затрат на расплавление вещества. Ограничение электролитического метода извлечения металлов из водных растворов состоит в том, что он пригоден лишь для металлов, стоящих в ряду активности металлов правее алюминия.
Особенность проведения электролиза водных растворов солей заключается в том, что наряду с процессами восстановления ионов металла на катоде и окисления анионов соли на аноде протекает конкурирующий процесс электролиза молекул воды. В результате на катоде может выделяться водород, а на аноде — кислород.
|
Процессы на катоде: 2Н+ + 2е– = Н2↑ при рН < 7; 2Н2О + 2е– = Н2↑ + 2ОН– ≥ 7. |
Процессы на аноде: 2Н2О – 4е– = О2↑ + 4Н+ при рН ≤ 7; 4ОН– – 4е– = О2↑ + 2Н2О при рН > 7. |
Способность металлов восстанавливаться на катоде при электролизе водного раствора солей определяется положением металла в ряду активности.
Катионы металлов в левой части ряда активности, заканчивая алюминием (Li+, Na+, K+, ... Аl3+), при электролизе не восстанавливаются. Вместо них восстанавливается водород из молекул воды:
2Н2О + 2е– = Н2↑ + 2ОН–.
Катионы металлов, расположенных в ряду активности правее водорода (Cu2+, Ag+, Hg2+, Pt2+, Au3+), при электролизе восстанавливаются на катоде до металла:
Cu2+ + 2е– = Cu0;
Au3+ + 3е– = Au0.
Этот процесс доминирует, но если электролит имеет сильно кислую среду, то одновременно с ионами металла могут восстанавливаться ионы водорода:
2H+ + 2е– = Н2↑.
Катионы металлов, расположенных в ряду активности между алюминием и водородом (Mn2+, Zn2+, Сr3+, Fe2+, ... Pb), при электролизе восстанавливаются на катоде одновременно с водородом из воды:
Ni2+ + 2e– = Ni0;
2Н2О + 2е– = Н2↑ + 2ОН–.
При электролизе водных растворов солей металлов следует учитывать возможность протекания процессов гидролиза, который ускоряется в результате образования гидроксид-ионов в электролите вблизи катода. В результате на поверхности катода могут образовываться нерастворимые основные соли и основания:
2Cu2+ + + 2ОН– → (CuOH)2SO4;
Ni2+ + 2OH– → Ni(OH)2.
Электропроводность электрода уменьшается, и процесс электролиза замедляется или прекращается. Один из способов борьбы с таким явлением — подкисление электролитов.
На аноде протекают процессы окисления компонентов электролита. В процессе окисления может участвовать и материал самого анода. Различают процессы электролиза в растворах с активным и инертным анодами.
Инертные аноды не окисляются под действием электрического тока и не реагируют с веществами раствора. При электролизе они служат лишь передатчиками электронов. Инертными являются электроды из графита, платины, платинированного титана.
К активным относятся аноды, изготовленные из Сu, Ag, Fe, Ni, Sn, Zn. Металл активных анодов в процессе электролиза разрушается и переходит в раствор в виде ионов. Активные аноды обычно применяют в промышленности при получении покрытий путем электрохимического восстановления металлов из растворов, поскольку растворение металлического анода в процессе электролиза восполняет убыль ионов восстанавливаемого металла из электролита. При этом они обеспечивают постоянство состава раствора, скорости процесса электролиза, состава и свойств получаемых металлических покрытий.
Рассмотрим подробнее процессы, протекающие при электролизе растворов на инертных анодах. Можно выделить следующие закономерности (табл. 31.1):
• в растворах бескислородных кислот и их солей (кроме HF и фторидов) на аноде окисляются анионы, например:
2Cl– – 2e– = Cl2↑;
• в растворах кислородсодержащих кислот и их солей в случае максимальной степени окисления атомов неметалла в анионе (,
) окисляются атомы кислорода в молекулах воды с выделением газообразного кислорода:
2Н2О – 4е– = О2↑ + 4Н+;
• в растворах кислородсодержащих кислот и их солей, в анионах которых содержатся атомы неметалла в промежуточной степени окисления (,
), окисляются именно эти атомы в составе анионов, например:
– 2e– + 2OH– =
+ H2O.
Таблица 31.1. Об этом говорит сайт https://intellect.icu . Способность к окислению на аноде анионов при электролизе водных растворов солей
| Анионы кислородсодержащих кислот и фторид-ион | Анионы бескислородных кислот |
| Cl−, Br−, I−, S2− | |
|
В водном растворе не окисляются; окислению подвергаются молекулы воды с выделением кислорода: 2Н2О – 4е– = О2↑+ 4Н+ |
В водном растворе легко окисляются, например: 2Cl– – 2e– = Cl2↑ |
В специально созданных условиях в водных растворах может идти процесс окисления и кислородсодержащих анионов с максимальной степенью окисления неметалла. Например, электролизом концентрированного раствора гидросульфата калия получают сильный окислитель — пероксодисульфат калия:
2KHSO4 K2S2O8 + H2↑.
При разработке условий электролиза следует учитывать, что продукты электролиза могут вступать в химические реакции с электродами и водными растворами или между собой.
Промышленный электролиз водного раствора NaCl. Процесс используют для получения водорода, хлора и каустической соды (NaOH). При этом на катоде выделяется водород:
2Н2О + 2е– = Н2↑ + 2ОН–,
на аноде — хлор:
2Cl– – 2e– = Cl2↑,
а в растворе накапливается каустическая сода:
2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑.
Если не разделить продукты электролиза, то между образовавшимися газами произойдет химическая реакция.
В растворе также возможно взаимодействие хлора со щелочью:
Cl2 + 2NaOH = NaClO + NaCl + H2O.
Для того чтобы между продуктами электролиза не происходило взаимодействие, катодное и анодное пространство разделяют мембраной (рис. 108.2).

Рис. 108.2. Схема электролизера с ионообменной мембраной для электролиза раствора хлорида натрия. Мембрана пропускает ионы Na+, но не пропускает ионы Cl– и OH–
Продукцией цеха мембранного электролиз являются: водный раствор гидроксида калия (с массовой долей KOH 46−54 %); твердый гидроксид калия (с массовой долей KOH 90−95 %); соляная кислота (с массовой долей HCl 28−35 %); гипохлорит натрия NaClO.
Электролиз растворов солей в лаборатории.
Для наглядности при рассмотрении особенностей электролиза водных растворов солей обратимся к химическому эксперименту.

Рис. 108.3. Схема прибора для электролиза:
1 — U-образная трубка (электролизер);
2 — штатив;
3 — электроды (графитовые стержни);
4 — источник питания постоянного тока
Опыт 1. Проведем электролиз водного раствора CuSO4. Для этого соберем прибор по схеме, представленной на рис. 108.3. В U-образную трубку нальем раствор сульфата меди(II) и опустим два графитовых стержня, закрепленных в резиновых пробках. Стержни с помощью проводов присоединим к источнику тока, на котором поддерживается напряжение постоянного тока до 12 В.

Рис. 108.4. Осажденная медь на графитовом электроде после проведения электролиза раствора сульфата меди(II)
При пропускании электрического тока через раствор CuSO4 на стержне, присоединенном к положительному полюсу источника тока (анод), можно наблюдать выделение пузырьков газа (это кислород), а на стержне, присоединенном к отрицательному полюсу (катод), — появление красного налета (это восстановленная медь) (рис. 108.4).
Объяснить наблюдаемое явление можно следующими процессами.
В растворе сульфата меди происходит диссоциация:
CuSO4 → Cu2+ + .
При подключении электродов к источнику тока в растворе электролита происходит направленное движение ионов к электродам, имеющим противоположные заряды.
На катоде происходит восстановление меди, которая образует красный налет на электроде:
Сu2+ + 2e– = Сu0
На аноде (положительно заряженном электроде) происходит окисление молекул воды с выделением кислорода:
2Н2О – 4e– = О2↑ + 4Н+.
Суммарное уравнение процессов на электродах в молекулярной форме:
2СuSO4 + 2Н2О 2Сu0 + О2↑ + 2Н2SO4.
Опыт 2. Проведите электролиз водного раствора йодида калия.
Для проведения электролиза раствора KI воспользуемся установкой из примера 1 (рис. 108.3).
В U-образную трубку нальем раствор KI и пропустим через него электрический ток. Через 3–5 минут, отключив ток и достав электроды, в катодное пространство добавим 2−3 капли фенолфталеина, а в анодное пространство прильем крахмальный клейстер.

Рис. 108.5. Электролизер после проведения электролиза раствора йодида калия и добавления раствора фенолфталеина (катодное пространство) и крахмального клейстера (анодное пространство)
Раствор в катодном пространстве окрашивается в малиновый цвет, что свидетельствует о щелочной среде. В анодном пространстве наблюдается выделение желто-бурого вещества, при добавлении к которому 2–3 капель крахмального клейстера происходит посинение раствора, что указывает на присутствие в растворе йода (рис. 108.5).
Таким образом, продуктами электролиза водного раствора йодида калия являются I2 и щелочь.
Наблюдаемые явления свидетельствуют о протекании на электродах следующих реакций:
2Н2О + 2e– = Н2↑ + 2ОН– на катоде;
2I– – 2e– = I2 на аноде.
Суммарное уравнение процесса электролиза в молекулярной форме:
2Н2О + 2KI Н2↑ + I2 + 2KОН.
Электролиз с активными анодами в промышленности. Помимо электрохимического осаждения металлических покрытий и получения порошков металлов, этот метод применяют для извлечения металлов из растворов, а также для очистки (рафинирования) металлов от содержащихся в них примесей. Так получают чистое золото, медь и многие другие металлы.
Например, при очистке (рафинировании) меди исходный металл, содержащий нежелательные примеси, служит анодом. Анод погружают в раствор сульфата меди(II). При пропускании тока медь на аноде окисляется, ее ионы переходят в раствор, перемещаются к катоду и на нем восстанавливаются. Примеси в этом процессе не участвуют из-за их малой концентрации, и поэтому на катоде образуется слой чистой меди.
Процессы электролиза с активными анодами используют для получения покрытий из оксидов металлов. Так, при проведении электролиза с анодом из алюминия его поверхность окисляется, покрываясь слоем оксида. Такой процесс специального наращивания оксида на поверхности металла называют электрохимическим оксидированием (или анодированием). Анодирование применяют для защиты металла от коррозии, придания его поверхности декоративного внешнего вида, повышенной твердости.
Методом электролиза растворов солей на поверхность различных изделий наносят покрытия из металлов и их сплавов, композитов с неметаллами, что придает изделиям нужные свойства (повышенная коррозионная стойкость, декоративная отделка, электропроводность и др.). К распространенным промышленным процессам относятся цинкование, никелирование, меднение, хромирование, оловянирование, золочение и серебрение.
В НИИ разрабатуют и внедряют в промышленность процессы электрохимического осаждения покрытий из сплавов металлов и композиционных покрытий металл — оксид металла, например: Ni—B, Ni—P, Ni—Sn, Au—Co, Сu—CuO—Cu2O, Ni — алмаз (алмаз в виде тонко измельченного порошка). Такие покрытия более твердые, износо- и коррозионностойкие, чем покрытия из индивидуальных металлов, обладают декоративным внешним видом (рис. 108.6).
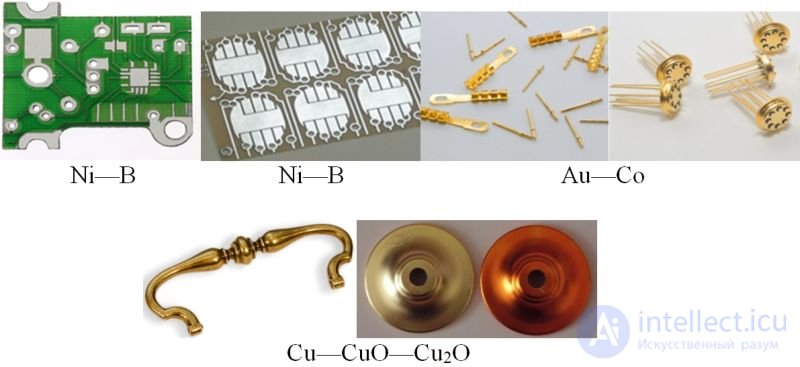
Рис. 108.6. Покрытия на часовых платах, платах кредитных карточек, корпусах транзисторов, фурнитурных изделиях
Электролиз водных растворов используется также в синтезе различных неорганических веществ, в обработке поверхностей металлов (азотирование, борирование, электрополировка, очистка), в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации). Электролизом получают кислород и водород.
При электролизе водных растворов солей на катоде восстанавливаются катионы металлов, расположенных в ряду активности после водорода.
На катоде не восстанавливаются катионы металлов IA- и IIA-групп, расположенных в начале ряда активности, а также алюминий, вместо них восстанавливается водород из молекул воды.
На катоде одновременно с водородом из воды восстанавливаются катионы металлов, расположенных в ряду активности между алюминием и водородом.
На аноде в растворах солей бескислородных кислот окисляются анионы (кроме фторид-ионов).
На аноде в растворах солей кислородсодержащих кислот с максимальной степенью окисления неметалла (,
) окисляются молекулы воды с выделением кислорода.
1. Какие из веществ — каменная соль, сахар, медный купорос, глицерин, серная кислота — могут подвергнуться электролизу в водном растворе?
2. Объясните, почему алюминий нельзя получить электролизом водного раствора его хлорида.
3. Приведите уравнения реакций на электродах при электролизе водного раствора сульфата никеля(II).
4. Сравните продукты электролиза расплава и водного раствора хлоридов натрия, никеля(II) и меди(II). Приведите соответствующие уравнения химических реакций.
5. При электролизе водного раствора хлорида натрия без разделения электродных пространств можно получить гипохлорит натрия. Приведите возможные уравнения электродных процессов и химических реакций в растворе.
6. Продукцией цеха мембранного электролиза ОАО «Беларуськалий» являются водный раствор гидроксида калия и соляная кислота. Приведите уравнения реакций, которые лежат в основе получения этих веществ.
7. Как изменится концентрация катионов и анионов в водных растворах CuCl2, Na2SO4, KI, NaOH, HCl при электролизе? Приведите соответствующие уравнения реакций.
8. В качестве лабораторного способа дезинфекции воды используется электролиз водного раствора хлорида натрия в портативных электролизерах. Объясните процессы, на которых основан этот способ дезинфекции воды.
9. Сырьем для получения цинка является руда, содержащая цинковую обманку (ZnS). Продукт ее обжига растворяют в серной кислоте и после нескольких стадий очистки от примесей (Cu2+, Fe2+, Fe3+ и др.) подвергают электролизу. Приведите уравнения химических реакций, иллюстрирующих все основные стадии получения цинка.
10. Оксид марганца(IV) получают электролизом раствора сульфата марганца(II) в присутствии серной кислоты. Предположите, какие процессы протекают на электродах и приведите уравнения соответствующих реакций.
1. При электролизе водных растворов солей восстанавливаются ионы:
2. При электролизе водных растворов солей не восстанавливаются ионы:
3. Продуктами электролиза водного раствора калийной соли являются:
4. На катоде могут протекать процессы:
5. При электролизе водного раствора хлорида натрия выделился водород объемом 2,24 дм3 (н. у.). Число электронов, отданных при этом ионами хлора, равно:
Исследование, описанное в статье про 45.1. Получение металлов электролизом водных растворов солей, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое 45.1. Получение металлов электролизом водных растворов солей и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Неорганическая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Неорганическая химия
Термины: Неорганическая химия