Лекция
Привет, Вы узнаете о том , что такое соединения галогенов, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое соединения галогенов , настоятельно рекомендую прочитать все из категории Неорганическая химия.
К важнейшим соединениям галогенов относят галогеноводороды состава НЭ (Э — элемент галоген) и их водные растворы — галогеноводородные кислоты, а также образуемые ими соли. Атомы в молекулах галогеноводородов связаны ковалентной полярной одинарной σ-связью. На рисунке 70 показано образование химической связи в молекуле HCl.

Рис. 70. Модели образования химической связи в молекуле хлороводорода
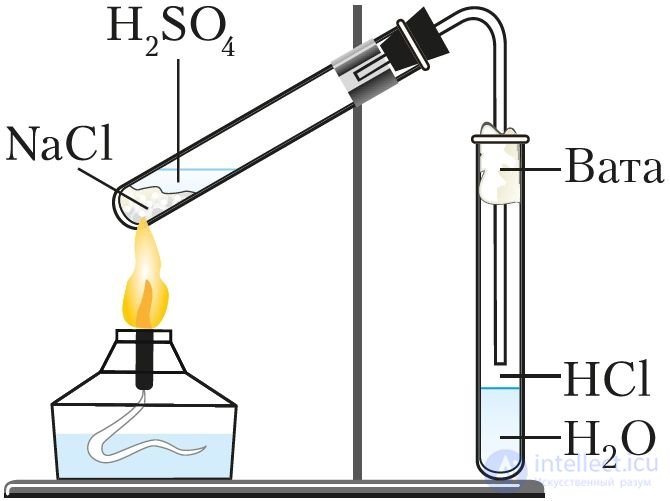
Рис. 71. Получение соляной кислоты в лаборатории
Хлороводородная (соляная) кислота HCl — крупнотоннажный продукт химической промышленности. Oна является водным раствором хлороводорода, который представляет собой бесцветный газ с резким запахом. Растворимость HCl при 20 °С составляет около 450 объемов на 1 объем воды.
Концентрированная соляная кислота, содержащая 36–38 % хлороводорода и имеющая плотность 1,19 г/см3, дымит на воздухе, так как из нее выделяется газообразный хлороводород. Разбавленные растворы НСl не дымят.
В промышленности соляную кислоту получают растворением в воде хлороводорода. При этом хлороводород синтезируют из простых веществ:
H2 + Cl2 = 2HCl.
В лабораторных условиях хлороводород получают действием концентрированной серной кислоты на хлориды (NaCl или KCl) при нагревании (рис. 71):
.
Химические свойства. Являясь сильным электролитом, хлороводородная кислота диссоциирует с образованием ионов водорода и хлорид-ионов:
HCl → H+ + Cl–
и обладает всеми общими свойствами кислот: действует на индикаторы и образует соли (хлориды) при взаимодействии с металлами (1), основными и амфотерными оксидами (2), гидроксидами металлов (3), солями (4):
| 1 | Fe + 2HCl = FeCl2 + H2↑ металл |
Fe0 + 2H+ = Fe2+ + H2↑ |
| 2 | МgO + 2HCl = MgCl2 + H2O оксид основный |
MgO + 2H+ = Mg2+ + H2O |
| ZnO + 2HCl = ZnCl2 + H2O оксид амфотерный |
ZnO + 2H+ = Zn2+ + H2O | |
| 3 | КOH + HCl = КCl + H2O основание (щелочь) |
H+ + OH– = H2O |
| Al(OH)3 + 3HCl = AlCl3 + 3H2O амфотерный гидроксид |
3H+ + Al(OH)3 = Al3+ + 3H2O | |
| 4 | Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ соль |
2H+ + |
К специфическим свойствам соляной кислоты следует отнести реакции, обусловленные наличием аниона Сl–. Выделим два важнейших.
1. Реакции окисления хлорид-ионов. Ион хлора в составе хлороводородной кислоты имеет низшую степень окисления –1 и способен ее повышать при потере электронов. Значит, за счет ионов хлора кислота является восстановителем. Например, для получения хлора в лаборатории используют реакцию концентрированной соляной кислоты с сильными окислителями (МnO2, КМnO4, КClO3):
.
2. Реакции связывания аниона Сl– c катионами некоторых металлов, например свинца Pb2+, серебра Ag+ в растворе. Это иллюстрируют уравнения реакций:
2HCl + Pb(NO3)2 = PbCl2↓ + 2HNO3;
Pb2+ + 2Cl– = PbCl2↓;
HCl + AgNO3 = AgCl↓ + HNO3;
Ag+ + Cl– = AgCl↓.
Действие нитрата серебра(I) приводит к образованию белого творожистого осадка AgCl, что используют как тест (качественная реакция) на хлорид-ионы (Приложение 3).
Фтороводород HF является жидкостью при температурах ниже 19 °С, а HCl, HBr, HI — газообразные вещества при н. Об этом говорит сайт https://intellect.icu . у. (табл. 23). Резкое отличие НF по агрегатному состоянию можно объяснить образованием водородных связей между полярными молекулами вещества: H—F … H—F … H—F … H—F.
Таблица 23. Галогеноводороды
| Галогеноводороды | HF | HCl | HBr | HI |
| Длина связи, нм | 0,092 | 0,128 | 0,141 | 0,161 |
| Энергия связи, кДж/моль | 565 | 431 | 364 | 297 |
| Температура плавления, °С | –83 | –114 | –87 | –51 |
| Температура кипения, °С | 19,5 | –85 | –67 | –35 |
| Агрегатное состояние (при н. у.) | Жидкость | Газ | Газ | Газ |
Ассоциаты молекул фтороводорода настолько прочны, что не разрушаются (присутствуют) даже в газовой фазе до 90 °С. Фтороводород обладает неограниченной растворимостью в воде. Его раствор является слабой кислотой (фтороводородная кислота): . Низкая сила кислоты НF обусловлена высокой прочностью (энергией) связи в молекуле.
Плавиковая (фтороводородная) кислота способна разрушать («плавить») стекло Na2O ∙ CaO ∙ 6SiO2 в соответствии с уравнением:
6НF + SiO2 = H2SiF6 + 2H2O
или 4HF(г) + SiO2 SiF4↑ + 2H2O.
Остальные галогеноводороды хорошо растворимы в воде и представляют собой сильные кислоты: HBr → H++ Br–; HI → H+ + I–.
Большинство солей, образуемых этими кислотами, хорошо растворимы в воде. Для качественного определения в растворах хлорид-, бромид- и йодид-ионов используют реакцию с раствором нитрата серебра(I) AgNO3. При этом хлориды образуют белый творожистый осадок AgCl, бромиды — светло-желтый AgBr, йодиды — желтый AgI (табл. 24, Приложение 3):
Ag+ + Cl– = AgCl↓; Ag+ + Br– = AgBr↓; Ag+ + I– = AgI↓.
Эти осадки не растворяются в азотной кислоте.
Нитрат серебра(I) не образует осадка с растворимыми фторидами, поэтому фторид-ионы определяют с помощью раствора CaCl2 (Приложение 3):
CaCl2 + 2NaF = CaF2↓ + 2NaCl; Ca2+ + 2F–= CaF2↓.
Таблица 24. Качественные реакции на анионы галогеноводородных кислот
| Название кислоты и ее химическая формула | Соли | Качественные реакции на анионы | |||
| Ион | Реактив | Признак реакции | |||
| Фтороводородная (плавиковая) | HF | Фториды | F– фторид |
CaCl2 | Белый осадок CaF2  |
| Хлороводородная (соляная) | HCl | Хлориды | Cl– хлорид |
AgNO3 | Белый творожистый осадок AgCl  |
| Бромоводородная | HBr | Бромиды | Br– бромид |
AgNO3 | Светло-желтый осадок AgBr  |
| Йодоводородная | HI | Йодиды | I– йодид |
AgNO3 | Желтый осадок AgI  |
Галогены находят широчайшее применение и как простые вещества, и в виде соединений. Это иллюстрируют данные таблицы 25.
Таблица 25. Применение галогенов и некоторых их соединений
| Галоген | Соединение | Важнейшие области применения |
| Фтор | Na3[AlF6] (криолит) | Производство алюминия |
| NaF (фторид натрия) | Добавка к зубным пастам. Медицинский препарат | |
| НF (плавиковая кислота) | Стекольная промышленность. Производство алюминия | |
| Термостойкий полимер. Антипригарное покрытие для сковородок, утюгов | ||
| Хлор | Cl2 (хлор) |
Обеззараживание питьевой воды. Отбеливание льняных и хлопчатобумажных тканей. Органический синтез. Извлечение цветных металлов из руды. Получение соляной кислоты |
| NaClO (гипохлорит натрия) | Компонент отбеливающих средств | |
| НCl (соляная кислота) | Химическая промышленность | |
| NaCl (галит) | Пищевая добавка. Сырье для производства хлора, натрия, гидроксида натрия | |
| Бром | Br2 (бром) | Органический синтез: производство антипиренов (ингибиторы горения), каучука, средств защиты растений. Производство медицинских препаратов |
| Йод | I2 (йод) | Медицина — спиртовой раствор (5–10 %). Фармацевтическая промышленность |
Хлор содержится в очень опасном для жизни и здоровья веществе — диоксине, который может образоваться в результате реакций органических веществ и хлора при повышенной температуре. Органические соединения хлора и фтора (например, фреоны) ученые считают одной из причин разрушения озонового слоя Земли.
Растворы галогеноводородов являются кислотами.
Хлороводород получают синтезом из простых веществ либо действием концентрированной серной кислоты на твердый хлорид натрия.
Соляная кислота является окислителем за счет водорода и восстановителем за счет хлора.
Обнаружить хлорид-, бромид- и йодид-ионы можно с помощью раствора нитрата серебра(I). Нерастворимые галогениды серебра различаются цветом: AgCl — белый, AgBr — светло-желтый, AgI — желтый.
1. Запишите химические формулы и назовите агрегатное состояние галогеноводородов при нормальных условиях.
2. Из перечня Mg(OH)2, FeCl2, FeCl3, Fe(NO3)3, HBr, HCl, MgCl2, ZnSO4 выпишите формулы и назовите вещества, которые при действии раствора AgNO3 образуют белый творожистый осадок.
3. Определите степени окисления атомов в соединениях: KClO3, HClO4, Cl2, KCl. В котором из них атомы хлора могут выступать только в роли восстановителя?
4. Определите массу хлороводорода в порции соляной кислоты массой 50 г с массовой долей вещества 12 %.
5. Рассчитайте объем хлороводорода (н. у.), который может выделиться при действии концентрированной серной кислоты на хлорид натрия массой 100 г.
6. Запишите химические формулы веществ, реагирующих с соляной кислотой: медь, оксид меди(II), оксид кальция, оксид углерода(IV), железо, гидроксид цинка, сульфат натрия, карбонат натрия. Объясните свой выбор. Составьте уравнения соответствующих реакций.
7. Предложите план экспериментального определения растворов йодида калия, бромида натрия и фторида натрия, находящихся в пронумерованных пробирках, используя:
Запишите уравнения соответствующих реакций в молекулярной и ионной формах.
8. Объясните причины нарушения последовательного изменения температур кипения галогеноводородов на рисунке 44 в § 17.
9. Определите массовую долю вещества в растворе, полученном при растворении хлороводорода объемом 40 дм3 (н. у.) в воде объемом 120 см3.
10. Для получения брома газообразный хлор пропустили через раствор массой 2 кг с массовой долей бромида калия 0,12 %. Рассчитайте массу полученного брома.
1. Самой слабой кислотой является:
2. Водный раствор фтороводорода содержит частицы:
3. Соляная кислота реагирует с:
4. Белый творожистый и желтый осадок соответственно при взаимодействии с нитратом серебра(I) образуют:
5. Газообразный хлороводород можно получить взаимодействием:
Исследование, описанное в статье про соединения галогенов, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое соединения галогенов и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Неорганическая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Неорганическая химия
Термины: Неорганическая химия