Лекция
Привет, Вы узнаете о том , что такое азотная кислота, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое азотная кислота , настоятельно рекомендую прочитать все из категории Неорганическая химия.
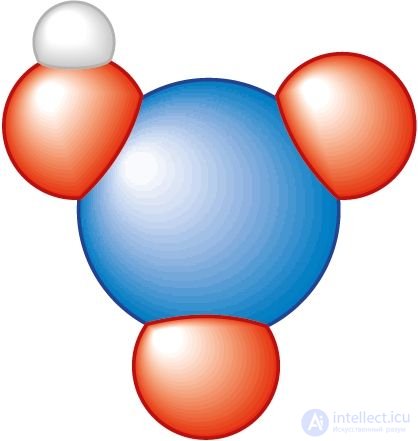
Рис. 95. Масштабная модель молекулы азотной кислоты
Азот образует несколько кислот, важнейшей из которых является
азотная кислота HNO3. Ей соответствует оксид с атомами азота в степени окисления +5: .
В молекуле кислоты атом азота образует четыре ковалентные связи: три из них — по обменному механизму, а одну — по донорно-акцепторному (см. с. 86).
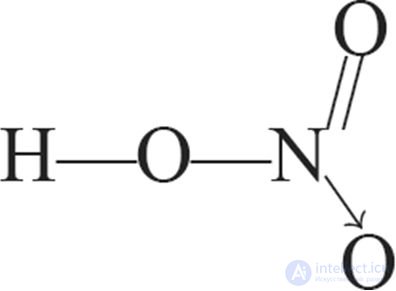
В соответствии с этим структурная формула молекулы азотной кислоты имеет вид:
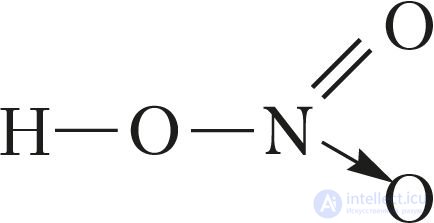 или
или 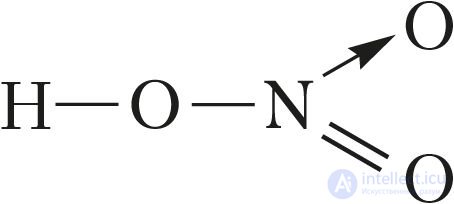
При этом атом азота имеет валентность IV, а степень окисления +5. Масштабная модель молекулы представлена на рисунке 95.
В основе промышленного получения азотной кислоты лежат реакции последовательного окисления аммиака, которые можно представить схемой:
и отразить уравнениями реакций:
1) каталитическое окисление аммиака:
;
2) самопроизвольное окисление оксида азота(II):
;
3) поглощение оксида азота(IV) водой в присутствии кислорода:
,
а также
.
В лаборатории азотную кислоту можно получить взаимодействием твердой соли (селитры — нитрата натрия или калия) с концентрированной серной кислотой:
.
Этот способ предложил еще в XVII веке немецкий химик и аптекарь Рудольф Глаубер, а полученную кислоту назвал «спиритус нитри» — «дух селитры».
Азотная кислота в интервале температур от ‒41,6 до +82,6 °С является жидкостью. Запах резкий, удушливый. Плотность — 1,51 г/см3 (меньше, чем у серной, но выше, чем у соляной кислоты). Смешивается с водой в любых соотношениях (неограниченная растворимость). При хранении может быть слегка окрашена в бурый цвет вследствие разложения с образованием бурого газа NO2:
4HNO3 = 4NO2↑ + 2H2O + O2↑.
HNO3 — сильная одноосновная кислота, проявляет общие свойства кислот, обусловленные ионом водорода, а окислительные свойства — за счет атома азота в достаточно высокой степени окисления +5.
I. Общие химические свойства. К общим химическим свойствам азотной кислоты относятся ее действие на индикаторы и образование солей. Изменение окраски индикаторов происходит за счет ионов водорода Н+, образующихся при диссоциации кислоты:
.
Соли (нитраты) образуются при взаимодействии с основными и амфотерными оксидами (1), гидроксидами металлов (2), другими солями (3):
| 1 | ||
| 2 | ||
| 3 |
II. Об этом говорит сайт https://intellect.icu . Окислительные свойства азотной кислоты. Эти свойства HNO3 проявляет в реакциях с металлами, неметаллами, органическими веществами.
Она окисляет металлы, расположенные в ряду активности как до водорода, так и после водорода, кроме золота и платины. Так, при взаимодействии концентрированной азотной кислоты с медью и другими малоактивными металлами (Ag, Hg и др.) продуктом восстановления является оксид азота(IV) — бурый газ:
,
а в разбавленной азотной кислоте — оксид азота(II):
.
Состав образующихся продуктов зависит как от концентрации азотной кислоты, так и от активности металла. При этом чем ниже концентрация азотной кислоты и выше активность металла, тем сильнее восстанавливается азот.
С более активными металлами продуктами восстановления могут быть N2O, NO, NO2, N2, NH4NO3. В общем виде взаимодействие азотной кислоты с металлами можно представить схемой:
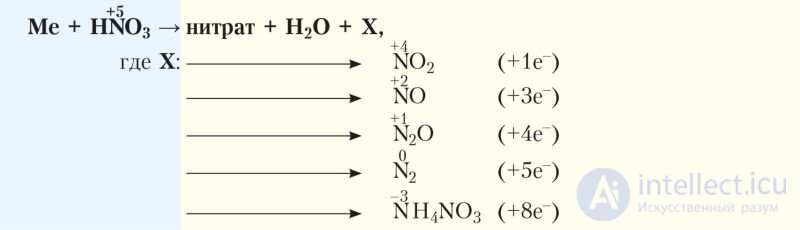
Как правило, в реакции образуется смесь продуктов восстановления с преобладанием отдельных из них.
Вспомним также (9 кл.), что концентрированная азотная кислота при низких температурах не взаимодействует с железом, хромом, алюминием, кобальтом — пассивирует их. Помимо металлов, азотная кислота окисляет многие неметаллы (C, S, P). Органические вещества в концентрированной кислоте могут воспламеняться (амины, скипидар).
Азотную кислоту применяют для получения нитратов, например:
Ее широко используют в органическом синтезе.

Нитрованием углеводородов получают нитросоединения (нитробензол — исходное вещество для синтеза анилина и красителей на его основе):
При взаимодействии с органическими веществами, содержащими ОН-группы (глицерин, целлюлоза), получают нитроэфиры:
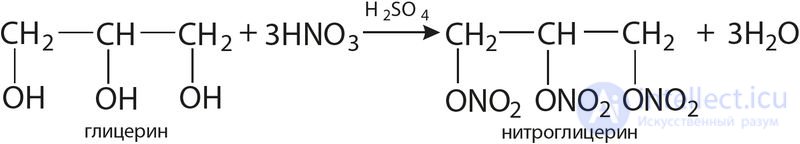
Нитроглицерин (нитроэфир) используют в медицине и для получения ряда сортов бездымного пороха.
Соли азотной кислоты все без исключения хорошо растворимы в воде. Важнейшим химическим свойством нитратов является их способность разлагаться при нагревании с образованием кислорода. Состав образующихся продуктов зависит от активности металла.
1. Нитраты щелочных и щелочноземельных металлов образуют нитрит и кислород:
.
2. Нитраты металлов, расположенных в ряду активности от магния до меди, разлагаются с образованием оксида металла, оксида азота(IV) и кислорода:
.
3. Нитраты металлов, расположенных в ряду активности после меди, при разложении образуют металл, оксид азота(IV) и кислород:
.
Термическое разложение нитратов можно представить схемой:
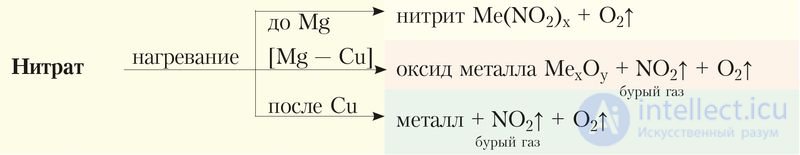
Выделение кислорода при разложении позволяет обнаружить нитрат по «вспышке твердой соли на раскаленном угольке» (Приложение 3).
Следует отметить, что нитрат аммония, разлагаясь при температуре не выше 200 °С, кислорода не образует:
.
Применение нитратов. Нитраты натрия, калия, кальция, аммония (NaNO3, КNO3, Са(NO3)2, NH4NO3) называют селитрами и используют в качестве удобрений. Еще одно важное направление использования нитратов — пиротехника: нитраты разлагаются при нагревании с выделением кислорода, который является сильным окислителем, особенно в момент выделения. Кислород при этом служит окислителем других компонентов пороха.
Разложение нитрата натрия можно использовать в лаборатории для получения кислорода:
(продукты — кислород и нитрит натрия — соль слабой азотистой кислоты).
Нитрат серебра(I) — составную часть ляписа — используют в медицинских целях. В пищевой промышленности используют нитрат и нитрит натрия как консерванты (Е251, Е250) для сыров и колбасных изделий. Мясным изделиям эти соли придают яркий розово-красный цвет. Этими солями пользовались еще древние греки и египтяне.
Азотную кислоту в промышленности получают из аммиака. Она окисляет все металлы, за исключением золота и платины. При взаимодействии меди с концентрированной азотной кислотой образуется, кроме соли и воды, оксид азота(IV) NO2, а с разбавленной — оксид азота(II).
Нитраты применяют в качестве азотных удобрений. Использование многих нитратов в пиротехнике основано на их способности разлагаться с выделением кислорода.
1. Выпишите из текста параграфа восемь формул нитратов.
2. Перечислите важнейшие физические свойства азотной кислоты.
3. Укажите окраску раствора азотной кислоты при добавлении:
4. Составьте формулы нитратов магния, лития, железа(III), бария.
5. Проанализируйте возможность протекания реакций в растворе между азотной кислотой и солями: хлорид калия, карбонат калия, сульфид натрия, сульфат натрия.
6. Составьте уравнения реакций в молекулярной и ионной формах между азотной кислотой и веществами, формулы которых: Fe2O3, Са(ОН)2, МgСО3.
7. Рассчитайте массу соли, которую можно получить в результате взаимодействия меди и раствора массой 50 г с массовой долей азотной кислоты 60 % (кислота концентрированная).
8. Методом электронного баланса расставьте коэффициенты в уравнениях реакций с участием азотной кислоты:
9. Запишите уравнения реакций согласно схеме:
10. Какой минимальный объем раствора азотной кислоты с массовой долей 80 % и плотностью 1,45 г/см3 необходим для растворения серебра массой 4,32 г? Реакция протекает по схеме:
Ag + HNO3 → AgNO3 + NO2↑ + H2O.
1. Структурные формулы азотной кислоты:
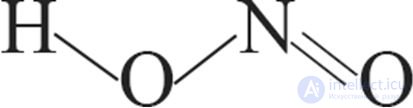
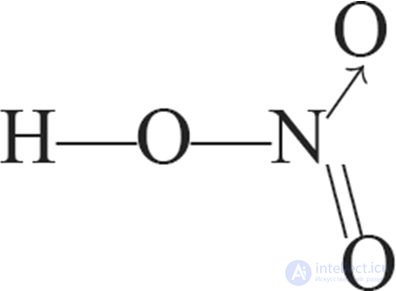
2. Правильными относительно азотной кислоты являются утверждения:
3. Продуктами взаимодействия разбавленной азотной кислоты с медью являются:
4. Азотная кислота вступает в реакции обмена с:
5. Селитрами называют обе соли в ряду:
Исследование, описанное в статье про азотная кислота, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое азотная кислота и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Неорганическая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Неорганическая химия
Термины: Неорганическая химия