Лекция
Привет, Вы узнаете о том , что такое соль, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое соль , настоятельно рекомендую прочитать все из категории Неорганическая химия.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
С позиций теории электролитической диссоциации солями называют сложные вещества, при диссоциации которых образуются катионы металлов и анионы кислотных остатков. К солям также относят неорганические соединения, содержащие ион аммония и кислотный остаток: NH4Cl, (NH4)2SO4.
Классификация и номенклатура
В зависимости от полноты замещения атомов водорода в кислотах или гидроксогрупп в составе оснований различают средние, кислые и основные соли. Кислые соли могут образовывать только многоосновные кислоты (Н2SO4, Н2СO3, Н2S, Н3РO4), основные соли — только многокислотные основания (Mg(OH)2, Cu(OH)2, Al(OH)3).
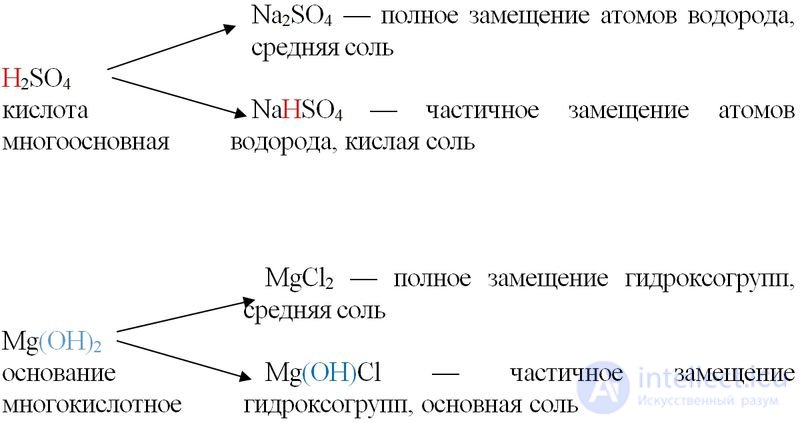
В основе систематических названий солей лежат названия кислотных остатков: MgSO4 — сульфат магния, Fe2(SO4)3 — сульфат железа(III). В названия основных солей перед названием металла добавляют слово «гидроксо»: Mg(OH)Cl — хлорид гидроксомагния, (СuOH)2CO3 — карбонат гидроксомеди(II) (малахит). Кислые соли называют, добавляя перед названием кислотного остатка слово «гидро-»: NaHCO3 — гидрокарбонат натрия (питьевая сода).
Твердые соли часто в своем составе содержат воду, и в этом случае их называют кристаллогидратами: FeSO4 ∙ 7H2O, Na2СO3 ∙ 10H2O. В их названиях указывают число молекул воды, приходящихся на одну формульную единицу безводной соли: CuSO4 ∙ 5H2O — пентагидрат сульфата меди(II), Na2SO4 ∙ 10H2O — декагидрат сульфата натрия. Их тривиальные названия — медный купорос, мирабилит (глауберова соль ).
Отдельную группу солей образуют комплексные соединения. В школьном курсе вы встретите небольшое число таких соединений, содержащих сложные, комплексные, ионы. Наиболее часто в состав комплексного иона входят катион металла и связанные с ним анионы или молекулы. При написании химических формул такие ионы заключают в квадратные скобки. Этим подчеркивают особо прочные связи между атомами в комплексном ионе. Примерами могут служить:
В курсе органической химии вы ознакомились с солями карбоновых кислот (ацетат натрия СН3СООNa, стеарат калия C17H35COOK (жидкое мыло)) и солями аминов (хлорид метиламмония СН3NH3Cl, гидросульфат фениламмония С6Н5NH3HSO4).
Физические свойства
Соли — твердые кристаллические вещества. Окраска солей может быть обусловлена как ионами металла, так и анионами кислотного остатка (рис. 6.4).

Рис. 6.4. Образцы солей: а — перманганат калия KMnO4, б — дихромат калия K2Cr2O7, в — хлорид калия KCl, г — карбонат гидроксомеди(II), или малахит, (СuOH)2CO3, д — декагидрат карбоната натрия Na2CO3 ∙ 10H2O
В зависимости от состава соли имеют разную растворимость в воде. Об этом говорит сайт https://intellect.icu . Самые простые сведения о ней приведены в «Таблице растворимости солей, кислот, оснований» (см. форзац учебника).
В водном растворе при диссоциации cолей образуются катионы металла и анионы кислотного остатка:
Na2SO4 → 2Na+ + (средняя соль);
NaHCO3 → Na+ + (кислая соль слабой кислоты);
NaHSO4 → Na+ + H+ + (кислая соль сильной кислоты);
Na2[Zn(OH)4] → 2Na+ + [Zn(OH)4]2− (комплексная соль).
Химические свойства солей
К общим химическим свойствам солей относят их взаимодействие с кислотами, щелочами, другими солями и металлами.
| Реагент и уравнение реакции | Особенности реакции |
|---|---|
| 1. Кислота: Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O |
Более сильная кислота вытесняет более слабую из ее соли |
| 2. Щелочь: CuCl2 + 2KOH = Cu(OH)2↓ + 2KCl |
Oбразуется нерастворимое основание и новая соль (сильные основания вытесняют слабые) |
| 3. Соль: BaCl2 + K2SO4 = BaSO4↓ + 2KCl |
Образуются две новые соли, одна из которых нерастворима |
| 4. Металл: CuSO4 + Fe = FeSO4 + Cu↓ |
Более активный металл вытесняет менее активный из раствора его соли |
| 5. Неметалл: Na2S + Cl2 = 2NaCl + S↓ |
Более активный неметалл вытесняет менее активный из раствора его соли |
| 6. Кислотный (амфотерный) оксид: Na2CO3 + SiO2 |
При сплавлении образуется новая соль и летучий оксид |
| 7. Термическое разложение: CaCO3 2Cu(NO3)2 |
При нагревании разлагаются, в основном, карбонаты и нитраты |
Реакции растворов солей с металлами имеют и другие особенности, кроме отмеченных выше. Действительно, более активные металлы вытесняют менее активные. Но если более активным является щелочной или щелочноземельный металл (Са, Sr, Ba, Ra), то в растворе он в первую очередь реагирует с водой, а образовавшаяся щелочь может вступить в реакцию с солью. Например, при опускании кусочка натрия в раствор сульфата меди(II) возможны такие реакции:
2Na + 2H2O = 2NaOH + H2↑,
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4,
то есть происходит реакция обмена между солью и образовавшейся щелочью.
Вследствие выделения значительного количества теплоты образующийся гидроксид разлагается до оксида, водород частично восстанавливает оксид:
Cu(OH)2 CuO + 2H2O;
CuO + H2 Cu + H2O.
Дополнительно можно отметить реакции солей бескислородных кислот с неметаллами, кислородсодержащих кислот — с кислотными и амфотерными оксидами, а также термическое разложение некоторых солей.
В главе IV вы рассмотрите еще одно важное свойство многих солей — способность подвергаться гидролизу.
Получение солей
Способы получения солей многочисленны и разнообразны, при этом они являются отражением химических свойств оксидов, кислот, оснований. Например, некоторые важнейшие способы можно представить как взаимодействие веществ различных классов. Это наглядно иллюстрируют приведенные ниже уравнения реакций.
| Реагенты | Уравнение реакции |
|---|---|
| Металл и неметалл | Cu + Cl2 = CuCl2 |
| Основный и кислотный оксиды | MgO + SiO2 |
| Основный оксид и кислота | FeO + H2SO4 = FeSO4 + H2O |
| Кислотный оксид и основание | CO2 + Ca(OH)2 = CaCO3↓ + H2O |
| Кислота и основание | HCl + NaOH = NaCl + H2O |
| Кислота и соль | 2HCl + CaCO3 = CaCl2 + H2O + CO2↑ |
| Щелочь и соль | 3NaOH + FeCl3 = Fe(OH)3↓ + 3NaCl |
| Металл и кислота | Mg + 2HCl = MgCl2 + H2↑ |
| Металл и соль | Fe + CuSO4 = FeSO4 + Cu |
| Неметалл и соль | Сl2 + 2KBr = 2KCl + Br2 |
Вопросы, задания, задачи
1. Выпишите формулы солей: NaOH, Na2SO4, Na2O, Cu(OH)2, CuCl2, Cu(NO3)2.
2. Запишите формулы солей: Mg(OH)NO3, (CuOH)2CO3, NaHCO3, KH2PO4, (NH4)2HPO4. Подчеркните формулы кислых солей.
3. Назовите соли: FeCl2, MgSO4, CaCO3, NaHCO3, Mg(OH)Cl, NaH2PO4.
4. Составьте формулы солей:
5. Составьте уравнения возможных реакций раствора нитрата железа(II) с веществами, формулы которых: Cu, Na, NaOH, Na2SO4, KNO3, HCl.
6. В каждом ряду укажите металл, способный вступать в реакцию замещения с водным раствором соли CuCl2:
Составьте уравнения соответствующих реакций.
7. Определите массовую долю соли в растворе, полученном при растворении медного купороса массой 25 г в:
8. Определите молярную концентрацию нитрата натрия в растворе:
9. Предложите пять способов получения соли:
10. После прокаливания нитрата меди(II) массой 9,4 г масса твердого остатка составила 5,08 г. Определите массу неразложившегося нитрата.
Самоконтроль
1. К солям относят вещества, формулы которых:
2. При умеренном нагревании разлагаются соли металлов:
3. Хлорид железа(II) может реагировать с:
4. Соль не образуется в реакции:
5. Для приготовления раствора объемом 0,5 дм3 сульфата меди(II) c молярной концентрацией 0,01 моль/дм3 необходимо взвесить медный купорос массой:
Подготовьте сообщение. Оксиды и соли в ювелирном магазине.
Исследование, описанное в статье про соль, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое соль и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Неорганическая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Неорганическая химия
Термины: Неорганическая химия