Лекция
Привет, Вы узнаете о том , что такое типы химической связи, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое типы химической связи , настоятельно рекомендую прочитать все из категории Неорганическая химия.
Изучив эту главу, вы сможете объяснять, почему атомы объединяются в молекулы и кристаллы, и устанавливать связь между их химическим составом и строением. Следовательно, вы научитесь прогнозировать свойства веществ по их формулам, и наоборот, по свойствам веществ — высказывать предположения об их строении. Теоретической основой для суждения о взаимосвязи свойств и строения веществ будут знания о типах химической связи, ее свойствах и механизмах образования.
Важнейшие понятия темы: химическая связь, ковалентная связь (полярная и неполярная), кратность связи, ион, ионная связь, металлическая связь, межмолекулярное взаимодействие, водородная связь, диполь, атомные, ионные, металлические, молекулярные кристаллы, валентность, валентные электроны, степень окисления.
Любое химическое соединение — молекулу (CO2), кристалл (NaCl), сложный ион () — с точки зрения электронного строения можно представить в виде системы, состоящей из атомных ядер и связывающих их электронов. Взаимодействие, которое делает эту систему устойчивой, называют химической связью.
Химическая связь — это взаимодействие, в результате которого отдельные атомы объединяются в более сложные системы (молекулы, кристаллы, ионы и др.).
Химическая связь обусловлена действием сил притяжения и отталкивания между положительно заряженными ядрами и отрицательно заряженными электронами, то есть имеет электростатическую природу.
Электроны, которые принимают участие в образовании химических связей, называют валентными. Это электроны внешних электронных оболочек атомов.
Рассмотрим, как и почему образуется химическая связь.
Основным условием образования химической связи является понижение полной энергии системы ядер и электронов по сравнению с энергией изолированных атомов.
Уменьшение полной энергии системы ядер и электронов достигается в результате совместного использования электронов разными атомами. В зависимости от того, как в результате распределена электронная плотность, различают три типа химической связи: ковалентную, ионную и металлическую.
Механизмы образования этих связей вы уже рассматривали при изучении химии в 8–10-х классах. Здесь мы дополним понятие химической связи представлениями о состоянии электронов в атоме.
Ковалентная связь — это химическая связь, образованная общими (связывающими) электронными парами. Ее называют локализованной, так как общая пара электронов размещается (локализуется) между двумя ядрами. Это заставляет положительно заряженные ядра притягиваться к паре электронов, расположенной между ядрами. Такая связь возникает между атомами с одинаковыми или близкими значениями электроотрицательности. Как правило, это атомы неметаллов.
Появление пары электронов, связывающей соседние атомы, можно представить двумя способами, то есть существует два механизма образования ковалентной связи — обменный и донорно-акцепторный.
Обменный механизм объясняет образование общей электронной пары из неспаренных валентных электронов, принадлежащих разным атомам. При этом электроны, образующие общую пару, должны иметь противоположные (антипараллельные) спины. Перекрывание двух электронных облаков приводит к увеличению электронной плотности между ядрами:

В образовании ковалентной связи могут участвовать s-, p- и d-электронные облака. Например, в связывании атомов хлора и водорода в молекуле H—Сl участвуют 1s-электрон атома водорода и неспаренный 3p-электрон атома хлора (рис. 24).

Рис. 24. Образование ковалентной связи в молекуле HCl
Каждый из связанных в общую электронную пару атомов приобретает электронную конфигурацию благородного газа: водород — гелия 1s2, а хлор — аргона 1s22s22р63s23р6. В результате оба атома достигают наиболее устойчивой электронной конфигурации.
Еще один пример — образование связей в молекуле аммиака NH3. У атома азота согласно электронно-графической схеме есть три неспаренных электрона: 7N 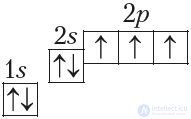 , у атома водорода — один
, у атома водорода — один . Эти электроны участвуют в образовании трех ковалентных связей по обменному механизму с атомами водорода:
 или
или 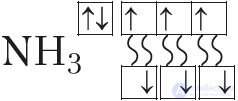
Отметим, что одновременно с этим у азота на 2s-орбитали остается неподеленная электронная пара — пара электронов, не принимающая участия в образовании химических связей.
Обменным механизмом объясняют образование ковалентной связи в подавляющем большинстве молекул органических и неорганических веществ, в атомных кристаллах алмаза C, красного фосфора P, карборунда SiC, кварца SiO2 и др.
Донорно-акцепторный механизм образования ковалентной связи предполагает образование общей пары электронов за счет передачи неподеленной электронной пары от одного атома (донора) на вакантную атомную орбиталь другого (акцептора). В качестве примера рассмотрим образование химической связи в катионе аммония при протекании реакции:
(хлорид аммония)
или в ионном виде:
(ион аммония).
Это взаимодействие можно представить электронными формулами:
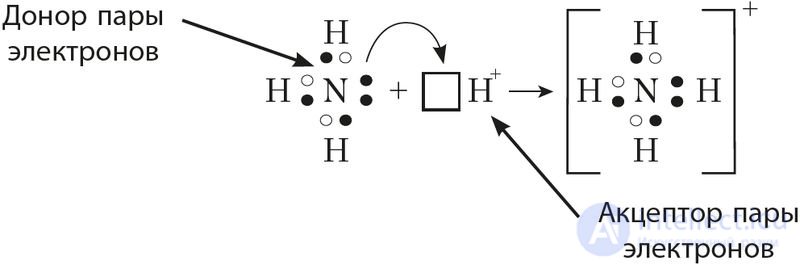
При взаимодействии молекулы 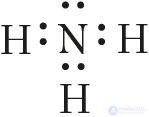 с катионом водорода
с катионом водорода , у которого на 1s-орбитали нет электронов, неподеленная пара электронов азота размещается на свободной 1s-орбитали
иона водорода. В результате образуется катион аммония
с четырьмя ковалентными связями:

Так как молекула аммиака электронейтральна, а присоединенный к ней ион имеет заряд «+», то образовавшийся катион аммония также имеет положительный заряд. Об этом говорит сайт https://intellect.icu . Этот заряд принадлежит целому иону, а не отдельному атому, поэтому в структурной формуле знак заряда иона ставят за квадратной скобкой: 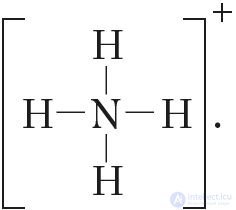 Если мы хотим подчеркнуть механизм образования связи, то можно стрелкой указать направление смещения электронной пары от донора к акцептору:
Если мы хотим подчеркнуть механизм образования связи, то можно стрелкой указать направление смещения электронной пары от донора к акцептору: 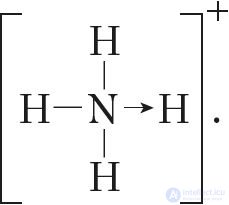 Но делать это необязательно, так как все связи в молекуле, независимо от механизма их образования, являются равноценными.
Но делать это необязательно, так как все связи в молекуле, независимо от механизма их образования, являются равноценными.
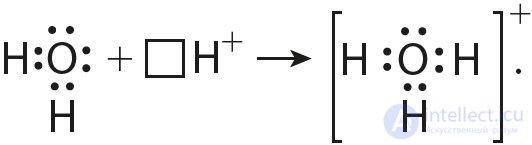
Аналогичным образом можно представить образование химической связи в катионе гидроксония H3O+: в результате гидратации иона водорода в водных растворах неподеленная электронная пара атома кислорода в молекуле воды размещается на свободной 1s-орбитали иона водорода.

Донорно-акцепторным механизмом объясняют образование ковалентной связи в молекулах угарного газа  , азотной кислоты
, азотной кислоты 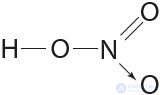 и др.
и др.
Ионная связь — это химическая связь, которая образуется в результате электростатического притяжения противоположно заряженных ионов.
В случае ковалентной связи валентные электроны, участвующие в ее образовании, локализованы между двумя связанными атомами. При образовании ионной связи электроны, напротив, считаются полностью перешедшими от одного атома к другому. В результате такого перехода электронов образуются ионы.
Образование ионов в кристаллах хлорида натрия представим, исходя из электронной конфигурации атомов натрия и хлора, следующим образом:
11Na 1s22s22p63s1 – e– → 11Na+ 1s22s22p6 (или Na – e– → Na+),
в сокращенном виде [Ne]3s1 – e– → [Ne];
17Cl 1s22s22p63s23p5 + e– → 17Cl– 1s22s22p63s23p6 (или Cl + e– → Cl–),
в сокращенном виде [Ne]3s23p5 + e– → [Ar].
Образующиеся ионы приобретают конфигурацию ближайшего благородного газа с октетом электронов на внешнем слое ns2nр6.
Переход электронов можно показать и с помощью электронных формул:
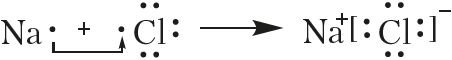
Из приведенных схем следует, что валентный электрон атома натрия полностью переходит на валентную оболочку атома хлора. Это приводит к возникновению ионов с противоположными зарядами.
Отметим, что для ионных соединений структурные формулы не составляют.
Возникает вопрос: почему в случае HCl образуется ковалентная, а в случае NaCl — ионная связь? Это объясняется различием в значениях электроотрицательности взаимодействующих атомов. Разность между значениями электроотрицательности атомов H и Cl значительно меньше, чем разность между значениями электроотрицательности Na и Cl. Это означает, что хлор гораздо сильнее притягивает к себе электрон натрия, чем электрон водорода. В результате происходит полный переход электрона от атома натрия к атому хлора.
Ионная связь главным образом образуется в галогенидах, гидроксидах и оксидах щелочных и щелочноземельных металлов. К этому типу также относят связь между катионом и анионом сложного состава, например в солях кислородсодержащих кислот (Na2SO4, NaNO3, (NH4)2SO4). В таких веществах существует два типа связей: ионная — между катионом и анионом, и ковалентная — между атомами неметаллов внутри катиона или иона сложного состава (рис. 25).

Рис. 25. Схема образования связей в хлориде аммония NH4Cl
Металлическая связь образуется в кристаллах металлов и металлических сплавов за счет обобществления всеми атомами их валентных электронов.

Рис. 26. Кристалл металла,
состоящий из регулярно
расположенных катионов металла
и свободно перемещающихся
электронов
Передача атомами металлов своих валентных электронов в коллективное пользование, наличие в металлах свободных электронов — причина электрической проводимости. Образование металлической связи можно описать следующим образом. В атомах металлов на внешнем энергетическом уровне содержится небольшое количество валентных электронов. В любом периоде периодической системы атомы металлов имеют по сравнению с атомами неметаллов больший радиус, меньшее количество валентных электронов и самый малый заряд ядра. Поэтому валентные электроны относительно слабо связаны с ядрами атомов и могут легко перемещаться по всему кристаллу металла. В результате кристалл состоит из положительно заряженных ионов, между которыми перемещаются свободные электроны, так называемый электронный газ (рис. 26).
В таблице 11 суммированы сведения о механизмах образования химических связей и распределении электронной плотности между химически связанными атомами.
Таблица 11. Образование ковалентной, ионной и металлической связей
| Тип связи | Характер обмена электронами между атомами | Условия взаимодействия между атомами |
| Ковалентная связь | Локализация связывающих электронных пар валентных электронов между положительно заряженными ядрами атомов. Возникает преимущественно между атомами неметаллов в молекулах и атомных кристаллах |

Образование общих |
| Ионная связь | Передача электронов от одного атома другому и образование кристалла из катионов и анионов. Возникает между атомами типичных металлов и неметаллов, в солях, многих оксидах, гидроксидах |

Электростатическое |
| Металлическая связь | Обобществление валентных электронов и их равномерное распределение в пространстве между всеми атомными ядрами. Возникает в металлах и сплавах |

Обобществление всех |
Химическая связь — это взаимодействие, в результате которого отдельные атомы объединяются в более устойчивые сложные системы (молекулы, кристаллы, ионы и др.).
Химическая связь имеет электростатическую природу.
При образовании химической связи полная энергия системы ядер и электронов понижается.
Выделяют три основных типа химической связи: ковалентная, ионная и металлическая, отличающиеся характером распределения электронной плотности между взаимодействующими атомами.
Существует два механизма образования ковалентной связи — обменный и донорно-акцепторный.
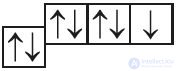
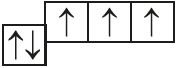
1. Определите тип химической связи, представленный электронными схемами:
| а) | 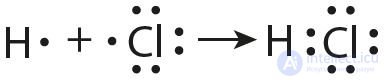 |
в) | 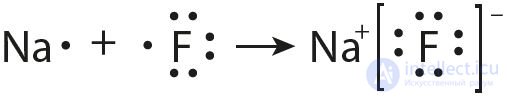 |
| б) |  |
г) |  |
2. Составьте электронные формулы молекул водорода, хлора, хлороводорода, воды, аммиака и укажите число связывающих и неподеленных электронных пар в каждой из них.
3. Укажите тип химической связи между атомами в следующих соединениях:
4. Сравните электронные схемы и электронные конфигурации:
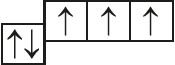
5. Назовите механизм образования связи между атомами, имеющими следующие электронно-графические схемы внешних электронных оболочек:
 и
и 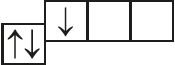
6. Согласно приведенной схеме объясните механизм образования ковалентной связи в ионе гидроксония при взаимодействии молекулы воды и иона водорода:
7. Используя значения электроотрицательности элементов (табл. 7), дайте обоснование типу химической связи в веществах и частицах: ,
,
,
,
,
.
| Химическая формула вещества или частицы | Электроотрицательность атомов | Разность электроотрицательностей ∆χ |
Тип химической связи | |
| χ1 | χ2 | |||
8. Укажите соединения, имеющие как ковалентную, так и ионную связь: НСООН, CH3COONa, MgF2, MgSO4, NH4NO3, HNO3, KNO3, CaSO4, NH3.
9. Рассчитайте число электронов, участвующих в образовании ковалентных связей в ионах аммония количеством 3 моль.
10. При образовании метана из атомов углерода и водорода выделяется 1662 кДж/моль энергии. Вычислите среднюю энергию связи С—Н (кДж/моль).
1. Верными являются утверждения:
2. За счет общих электронных пар образуются связи:
3. Ионная связь существует в веществах:
4. Азот выступил донором электронной пары в соединениях:
5. Электронную конфигурацию, сходную с конфигурацией атома аргона, имеют ионы:
Исследование, описанное в статье про типы химической связи, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое типы химической связи и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Неорганическая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Неорганическая химия
Термины: Неорганическая химия