Лекция
Привет, Вы узнаете о том , что такое 49. Железо и его соединения, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое 49. Железо и его соединения , настоятельно рекомендую прочитать все из категории Неорганическая химия.

Железо — элемент, расположенный в 4-м периоде, VIIIB-группе периодической системы. Электронная схема, формула электронной конфигурации и электронно-графическая схема его атома имеют вид:
 или 26Fe 2е–, 8е–, 14е–, 2е–;
или 26Fe 2е–, 8е–, 14е–, 2е–;
26Fe 1s22s22p63s23p63d64s2 или 26Fe [Ar]3d64s2;
26Fe 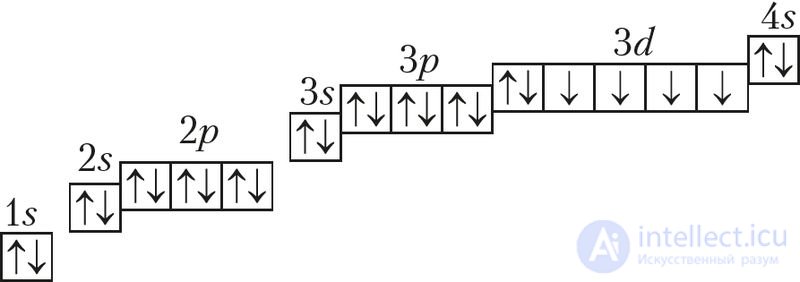
Железо относится к d-элементам. Наиболее устойчивыми степенями окисления атомов железа являются +2 и +3.
Железо — второй по распространенности после алюминия металл в земной коре (массовая доля — около 5 %). В неокисленном состоянии железо изредка встречается в метеоритах в составе сплава с кобальтом и никелем. В природе железо находится в виде соединений. Наиболее распространенными минералами, включающими железо, являются Fe2O3 (гематит), Fe3O4 (магнетит), FeO(OH) (гетит), FeS2 (пирит), FeCO3 (сидерит).
В Республике Беларусь открыто два месторождения железных руд — Новоселковское (Кореличский район Гродненской области) и Околовское (Столбцовский район Минской области). Они рассматриваются в качестве возможной сырьевой базы для металлургической промышленности нашей страны. Главный рудный минерал этих месторождений — магнетит.
Физические свойства. Железо представляет собой светлый серебристо-белый металл с плотностью 7,87 г/см3 и температурой плавления 1538 °С. Металл пластичен, относительно мягок: его относительная твердость по шкале Мооса равна 4 (Приложение 2).
При красном калении (выше 600 °С) железо размягчается и хорошо поддается сварке, ковке и прокатке. Отличительной особенностью железа являются его ярко выраженные магнитные свойства — ферромагнетизм.
Магнитными свойствами, кроме железа, обладают кобальт, никель и некоторые сплавы этих металлов, а также природный минерал магнетит. Ферромагнетики используют в электрогенераторах, трансформаторах, для звуко- и видеозаписи, в телефонах, компьютерах и др.
Химические свойства. По химическим свойствам металлическое железо — типичный металл. Вспомним особенности известных вам взаимодействий железа с неметаллами, водяным паром, кислотами и солями (табл. 35).
Таблица 35. Химические свойства железа
| Реагенты и уравнения (cхемы) реакций | Условия протекания и продукт реакции |
| Неметаллы | Железо при нагревании взаимодействует с неметаллами (азотом, бором, кремнием, фосфором, серой). Галогены окисляют железо до степени окисления +3 (кроме I2). При горении железа в кислороде образуется оксид, в котором имеются атомы железа(II) и железа(III) |
| Вода | При высокой температуре (около 800 °С) железо восстанавливает водород из водяного пара |
| Кислоты | Железо способно восстанавливать водород из кислот. Об этом говорит сайт https://intellect.icu . При комнатной температуре железо в концентрированных HNО3, H2SО4 не растворяется, так как они пассивируют его поверхность |
| Соли | Железо восстанавливает менее активные металлы из растворов солей |
Изделия из железа в технике, быту, природе подвергаются коррозии. Коррозия — разрушение металла в результате взаимодействия с веществами из окружающей среды.
Причины коррозии. Условно процесс коррозии железа во влажной атмосфере можно представить уравнением:
.
Образующийся Fe(OH)3 подвергается частичной дегидратации — удалению воды — и поэтому состав ржавчины выражают формулой Fe2O3 · xH2O.
При высоких температурах может происходить окисление сухим кислородом с образованием Fe3O4:
.
В окружающей среде в присутствии иных окислителей, например кислот и кислотных оксидов, образуются соли железа.
Во всех этих процессах железо окисляется и разрушается, компоненты окружающей среды восстанавливаются. Продукты окисления железа образуются в виде рыхлых слоев, не защищающих металл от дальнейшей коррозии (§ 20, рис. 47, б).
Скорость коррозии, как и в случае других окислительно-восстановительных процессов, зависит от химической природы и площади соприкосновения реагентов, их концентрации, температуры. Коррозию ускоряют растворы солей и кислот (рис. 113). Коррозию замедляют, полируя поверхность металла, сохраняя металл в сухом воздухе. Коррозия железа замедлена в растворах щелочей или при контакте с более активным, чем железо, металлом (рис. 114).
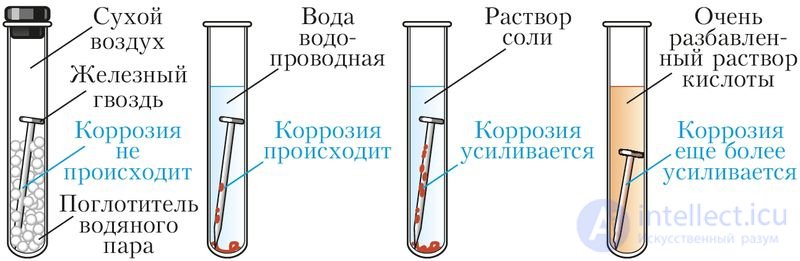
Рис. 113. Коррозия железа в средах различного состава
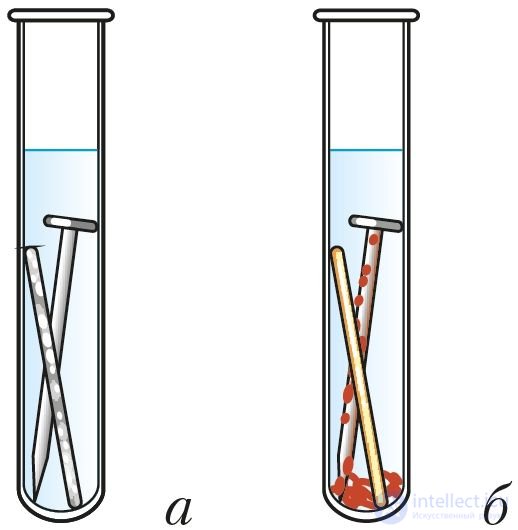
Рис. 114. Коррозия железа при контакте: а — с цинком, б — медью
Из курса химии 9-го класса вам известно, что скорость коррозии увеличивается при контакте железа с менее активным металлом (рис. 114).
Знание факторов, влияющих на скорость коррозии, позволило предложить ряд способов защиты от коррозии.
1. Защитные покрытия. В качестве материалов для металлических покрытий применяют цинк, никель, медь, хром, серебро, бронзу, латунь и др. (рис. 115). Так, оцинкованное железо используют в качестве кровельного материала, в изготовлении кузовов автомобилей, шурупов. В этом случае железо не будет разрушаться до тех пор, пока не прореагирует все покрытие из цинка. Покрытия из менее активных металлов, чем железо, защищают его от коррозии лишь в случае, если в них отсутствуют поры, трещины, царапины.

Рис. 115. Защитно-декоративные покрытия на изделиях из стали
К неметаллическим покрытиям относят лакокрасочные и полимерные материалы, смазочные масла.
Защитные покрытия также получают путем оксидирования (создание слоя окалины Fe3O4) и фосфатирования (нанесение слоя фосфатов) поверхности металла.

Рис. 116. Защита от коррозии подземного стального трубопровода
2. Электрохимическая защита осуществляется подключением защищаемой конструкции к отрицательному полюсу внешнего источника постоянного тока (катодная защита) или приведением защищаемого металла в контакт с более активным металлом (рис. 116).
3. Легирование металлов. В расплав металла при его производстве добавляют легирующие добавки — хром, никель, молибден и др., снижающие активность металла. Таким образом получают, например, нержавеющую сталь.
4. Изменение состава и свойств коррозионной среды. Коррозионную среду можно изменить добавлением в нее ингибиторов (веществ, которые значительно уменьшают скорость коррозии металла, например нитрита, фосфата или хромата натрия и ряда других).

Рис. 117. Изделия из чугуна
Применение железа и его сплавов. До 95 % всего добываемого железа производится в виде его сплавов — чугуна и сталей. С составом, свойствами и сферами применения этих сплавов вы уже ознакомились, изучая материал § 43, а с методами получения — в § 45. Напомним, что содержание углерода в сталях ниже 2 %, то есть гораздо меньше, чем в чугуне, поэтому сталь — более ковкий, прочный и менее хрупкий сплав по сравнению с чугуном. Она легко подвергается механической обработке (режется, шлифуется, прокатывается, куется).
Чугун — более дешевый сплав с хорошими литейными свойствами, но более хрупкий. Изделия из чугуна более коррозионноустойчивы, чем из нелегированной стали (рис. 117). Различие в свойствах определило и разные области использования сплавов железа.
Чистое железо используется как катализатор, например в синтезе аммиака, бромировании бензола.
Железо относится к d-элементам. Наиболее устойчивые степени окисления атомов железа +2 и +3.
Железо реагирует с неметаллами, водяным паром, кислотами и солями.
Изделия из железа и его сплавов подвергаются коррозии — разрушению в результате взаимодействия с веществами из окружающей среды. Ее можно замедлить нанесением покрытий, приведением в контакт с более активным металлом, легированием металла или изменением состава и свойств коррозионной среды.
1. Составьте формулу электронной конфигурации и электронно-графическую схему железа. Укажите число неспаренных электронов в основном состоянии атома железа.
2. Консервные банки из железа часто покрывают оловом. Этот процесс называют лужением. При появлении царапин на олове коррозия железной банки протекает быстрее, чем оцинкованного железа. Как это можно объяснить, используя положение металлов в ряду активности?
3. Какие заклепки — медные или алюминиевые — предпочтительнее использовать для скрепления двух железных деталей?
4. Почему нельзя готовить раствор медного купороса в железном ведре?
5. Три железные пластинки полностью погрузили в разбавленные растворы гидроксида калия, хлорида калия, уксусной кислоты, а четвертую — в дистиллированную воду. Опишите, что будет наблюдать экспериментатор через сутки.
6. Определите массу средней соли, образовавшейся при взаимодействии железа массой 11,2 г с достаточным количеством разбавленной серной кислоты.
7. Составьте уравнения реакций оксидов железа FeО, Fe2О3 и Fe3О4 с водородом, разбавленными серной и соляной кислотами.
8. Укажите направление смещения равновесия в системе
:
9. Железную пластинку массой 10 г выдержали в растворе медного купороса, содержащего cульфат меди(II) массой 2,4 г. Определите массу пластинки по окончании реакции.
10. Из каждой тонны железной руды, в которой массовая доля Fe3O4 равна 82 %, получен чугун массой 575 кг с массовой долей железа 95,5 %. Определите выход железа.
1. В атоме железа в основном состоянии имеется(-ются):
2. Коррозия железа усиливается:
3. При комнатной температуре железо реагирует с:
4. В реакции железа с водяным паром основным продуктом является:
5. Железо при взаимодействии с хлором и соляной кислотой образует соответственно:
Исследование, описанное в статье про 49. Железо и его соединения, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое 49. Железо и его соединения и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Неорганическая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Неорганическая химия
Термины: Неорганическая химия