Лекция
Привет, Вы узнаете о том , что такое значение периодической системы для науки, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое значение периодической системы для науки , настоятельно рекомендую прочитать все из категории Неорганическая химия.
Периодический закон и периодическая система химических элементов Д. И. Менделеева — величайшее открытие в истории науки (рис. 23). Оно определило начало новой эпохи в развитии химии. У химиков появился инструмент, позволяющий прогнозировать открытие новых элементов и проводить научные исследования, направленные на создание новых веществ и материалов.
Н. Бор назвал периодическую систему Менделеева «путеводной нитью в разработке теории электронного строения атома». На основании периодической системы были разработаны теория химической связи, концепции атомных и ионных радиусов, электроотрицательности и т. д. Структура «естественной системы химических элементов», разработанная Д. И. Менделеевым в 1869–1871 годах, оказалась настолько совершенной, что мало отличается от современной. Разумеется, многие открытия в области химии и физики вносили в нее изменения, но сбылись пророческие слова Д. И. Менделеева: «По-видимому, периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает».
Характеристика химического элемента по его положению в периодической системе и строению атома
По положению химического элемента в периодической системе можно дать довольно полную его характеристику. Ключевую роль играет атомный (порядковый) номер, определяющий строение атома. Строение электронной оболочки атома, в свою очередь, определяет состав образуемых простых и сложных веществ и их свойства.

Рис. 23. Памятник
Д. И. Менделееву на фоне
мозаичного панно периодической
таблицы (Санкт-Петербург)
Изучая химию в 8-м классе, вы уже составляли характеристику химического элемента. В 11-м классе вы будете более широко использовать приобретенные знания о строении атома и состоянии электронов в атоме и описывать элемент по следующему плану.
1. Положение в периодической системе (атомный номер, период, группа), относительная атомная масса.
2. Строение атома:
3. Степени окисления атомов элемента (высшая, низшая). Электроотрицательность.
4. Простое вещество: химическая формула, свойства простого вещества (агрегатное состояние при н. у., металл или неметалл).
5. Соединения элемента: высший оксид и соответствующий ему гидроксид, характеристика их кислотно-основных свойств; формула водородного соединения.
Д. И. Менделеев на основании разработанной им системы химических элементов исправил значения атомных масс и валентности ряда элементов (Ве, In, Mo, Sb, Ce, Te, Y, Th, U и др.), предсказал существование 10 еще не открытых элементов (Sc, Ga, Ge, Po, At, Tc, Fr, Pa, Hf, Re). Открытие этих элементов впоследствии стало триумфом периодического закона.
Следует отметить, что, составляя более развернутую характеристику, можно провести сравнение электроотрицательности, металлических или неметаллических свойств простого вещества, кислотно-основных свойств оксидов и гидроксидов с аналогичными свойствами других элементов в группе или периоде. Об этом говорит сайт https://intellect.icu . Предположения о свойствах веществ делает вполне уместным составление некоторых уравнений реакций. Например, можно подтвердить кислотные свойства записью уравнений реакций со щелочами, основные — с кислотами, амфотерные — и с кислотами, и со щелочами. Однако более детальные знания кислотно-основных и окислительно-восстановительных свойств элементов вы получите, изучая разделы «Неметаллы» и «Металлы».
Пример 1. По приведенному выше плану составьте характеристику элемента азот.
1. Элемент азот имеет химический знак N, атомный номер Z = 7. Азот расположен во втором периоде, малом, во IIA-группе, главной. Относительная атомная масса Ar(N) = 14.
2. Строение атома азота:
а) заряд ядра атома азота +7. В состав ядра атома азота входят 7 протонов. Самый распространенный в природе изотоп азота — это нуклид 14N. Число нейтронов в ядре этого нуклида равно 14 – 7 = 7;
б) электронная оболочка атомов азота содержит 7 электронов, которые распределены по двум энергетическим уровням; электронная схема: 7N 2e–, 5e–;
формула электронной конфигурации: 7N 1s22s22p3;
электронно-графическая схема:
7N 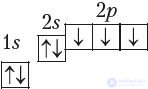
в) конфигурация внешнего электронного слоя: 2s22p3, значит, азот — p-элемент.
3. Степени окисления атомов элемента: высшая +5, так как на внешнем энергетическом уровне атома находится 5 электронов, низшая –3. Электроотрицательность: χ(N) = 3,0.
4. Простое вещество азот является неметаллом, агрегатное состояние при н. у. — газ, химическая формула N2.
5. Формула высшего оксида , оксид азота(V), кислотный;
формула гидроксида, соответствующего высшему оксиду, , гидроксид кислотный, азотная кислота;
водородное соединение , летучее, так как азот является неметаллом.
Именно познание закономерностей позволило Д. И. Менделееву не просто предсказать существование многих элементов, но и составить достаточно достоверную характеристику их свойств. На момент создания таблицы было известно всего лишь 63 химических элемента. Для неоткрытых элементов в таблице ему пришлось оставить пустые места, чтобы не нарушать периодичность. Так, элемент, который должен следовать за цинком и располагаться под алюминием, он назвал экаалюминием. Д. И. Менделееву нетрудно было догадаться, что его относительная масса будет около 70, так как у цинка она равна 65, а у следующего известного на то время элемента мышьяка — 75. Соединения алюминия с хлором при высокой температуре обладают летучестью, значит, и аналогичное соединение экаалюминия должно быть летучим. Описание свойств экаалюминия он заканчивал словами: «Можно надеяться, что он будет открыт спектральным исследованием, подобно тому, как открыты следующие за ним индий и таллий…» Таким образом, было дано не только описание свойств, но и способ обнаружения, задано направление поиска.
Прошло пять лет, и французский ученый Л. де Буабодран спектральным методом открыл новый элемент (галлий), выделив его из минерала, добытого в Пиренейских горах. Ученый был немало удивлен, когда через Парижскую академию наук получил письмо из России. В нем сообщалось, что в описании свойств галлия верно все, кроме плотности — не 4,7, а 5,9. Подвергнув металл более тщательной очистке, Буабодран убедился, что первоначально была допущена ошибка: плотность все-таки составляла 5,9.
Вы, наверное, успели догадаться, что автором письма был, конечно, Д. И. Менделеев.
По положению элемента в периодической системе можно дать довольно полную его характеристику, включая сведения о строении атома, возможных степенях его окисления и значениях электроотрицательности, составе и свойствах соединений атомов данного элемента и их свойствах, включая кислотно-основные и окислительно-восстановительные.
1. В чем вы видите значение периодического закона и периодической системы Д. И. Менделеева для развития науки?
2. По приведенному в тексте параграфа плану составьте описание следующих химических элементов:
3. Опишите положение в периодической системе элементов, имеющих конфигурацию внешнего электронного слоя:
4. Составьте уравнения реакций, подтверждающих кислотные свойства:
5. Составьте уравнения реакций с соляной кислотой:
6. Составьте уравнения реакций, подтверждающих амфотерность:
7. В каждой паре укажите элемент с большей электроотрицательностью:
8. Исходя из положения элементов в периодической системе, сравните кислотные свойства гидроксидов:
9. До открытия периодического закона относительная атомная масса бериллия принималась равной 13,8, а формула его оксида записывалась как Be2O3. Д. И. Менделеев поместил этот элемент в одну группу с магнием. Определите, как при этом должна была измениться атомная масса бериллия. Ответ подтвердите расчетом.
10. Относительная плотность по водороду водородного соединения состава Н2Э равна 17. Установите элемент.
1. В IVА-группе в 3-м периоде расположен элемент:
2. Химическому элементу с атомным номером 35 соответствуют записи:
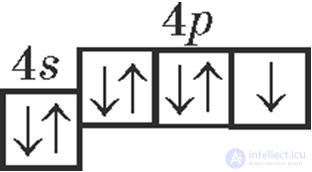 .
.3. Высший гидроксид состава Н2ЭО4 имеют элементы:
4. Соли образуются в реакциях кислот с высшими оксидами элементов:
5. Формула летучего водородного соединения элемента 5-го периода Н2Э. Укажите этот элемент:
Исследование, описанное в статье про значение периодической системы для науки, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое значение периодической системы для науки и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Неорганическая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Неорганическая химия
Термины: Неорганическая химия