Лекция
Привет, Вы узнаете о том , что такое озон, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое озон , настоятельно рекомендую прочитать все из категории Неорганическая химия.
Молекула озон а имеет угловое строение вследствие sp2-гибридизации орбиталей центрального атома кислорода, угол связи — около 117°. Строение молекулы озона представлено на рисунке 74.1.
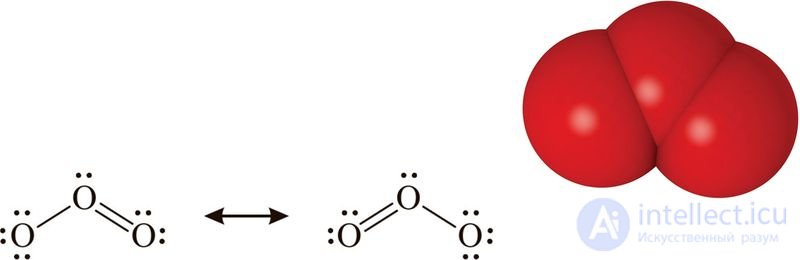
Рис. 74.1. Строение молекулы озона
Образование озона из кислорода — эндотермический процесс:
3О2 2О3 – Q.
В природе озон образуется из атмосферного кислорода при грозовых разрядах, а на высоте 10–30 км — под действием ультрафиолетового излучения. Образование озона из молекул кислорода в верхних слоях атмосферы схематически изображено на рисунке 74.2. Озоновый слой над поверхностью Земли задерживает вредное для жизни ультрафиолетовое излучение Солнца и поглощает инфракрасное излучение Земли, препятствуя ее переохлаждению. В этом важнейшая роль озона в жизни всего живого на нашей планете.
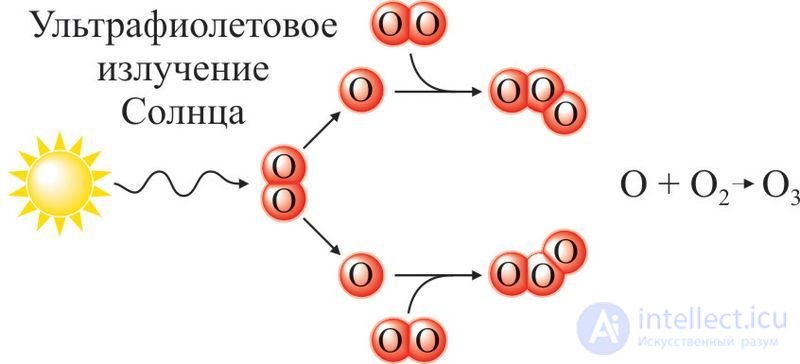
Рис. 74.2. Образование озона в природе
Существующий озоновый слой разрушается под действием фторированных и хлорированных углеводородов, оксида азота(I) и многих других веществ, входящих в состав хладагентов, пенообразователей, выхлопных газов, растворителей, многочисленных химикатов.
Озон образуется не только в природе, но и во время работы лазерных принтеров, копировальной техники, лазерных источников, газоразрядных и люминесцентных устройств, искусственных источников ультрафиолетового излучения, например ртутно-кварцевых ламп.
В промышленности озон получают из воздуха или кислорода под действием электрического разряда в специальных приборах — озонаторах.
Озон — газ с резким запахом, имеет голубой цвет, в жидком состоянии — синий. Плотность озона при н. у. в 1,5 раза больше плотности кислорода. Температура кипения –111,8 °С, что почти на 70 °С выше, чем у кислорода.
Озон очень токсичен. Его относят к первому, самому высокому классу опасности. Предельно допустимая концентрация (ПДК) озона в воздухе рабочей зоны — 0,1 мг/м3. Характерный запах озона начинает ощущаться уже при концентрациях 0,004–0,010 мг/м3, то есть во много раз ниже гигиенического норматива. Об этом говорит сайт https://intellect.icu . Это важно для персонала, работающего с озоном. Приборы, при работе которых генерируется озон, следует использовать только в хорошо проветриваемых помещениях.
Токсичность озона обусловлена его сильной окислительной способностью. Он раздражает и повреждает ткани органов дыхания. При его воздействии на организм в результате ряда реакций образуются свободные радикалы кислорода. Тем не менее именно благодаря этим свойствам озон обладает бактерицидным, противовирусным и противогрибковым действием.
1. При нормальных условиях озон может медленно самопроизвольно превращаться в кислород с выделением теплоты:
2О3 3О2 + Q.
Процесс ускоряется под действием катализаторов, УФ-облучения. Повышение температуры и понижение давления ускоряют этот процесс. Озон — более сильный окислитель, чем кислород, так как от его молекулы в процессе химических реакций легко отрывается один атом кислорода:
О3 = О2 + О.
Именно атомарный кислород принимает участие в реакциях окисления, а молекулы кислорода чаще всего являются одним из продуктов реакций. Например, озон реагирует с азотом при температуре 295 °С:
N2 + O3 = N2O + O2,
в то время как кислород взаимодействует с азотом при температуре более 3000 °С:
N2 + O2 = 2NO – Q.
2. Озон окисляет все металлы (за небольшим исключением, например, золота, платины):
.
3. Озон окисляет атомы элементов в низших степенях окисления в составе оксидов, гидроксидов, солей. Например:
.
4. Озон взаимодействует с раствором йодида калия. Даже без нагревания озон окисляет йодид-ионы, в результате чего выделяется свободный йод:
.
Эта реакция является тестом (качественной реакцией) на присутствие озона. Фильтровальная бумага, пропитанная смесью йодида калия и крахмала, синеет в озоне в результате выделения йода.
5. Озон разрушает органические вещества: красители обесцвечиваются, спирты, эфиры, скипидар воспламеняются, резина «стареет». Молекулы ненасыщенных органических соединений в реакциях с озоном разрываются по месту кратных связей.
Озон оказывает губительное действие на бактерии, поэтому используется для обеззараживания помещений и медицинского оборудования.
Озон — очень сильный окислитель, поэтому его применяют для обеззараживания воды. Озонирование воды, в отличие от ее хлорирования, не приводит к образованию хлорорганических веществ, которые токсичны и являются канцерогенами.
Озон образуется из кислорода при электрических разрядах и под действием ультрафиолетового излучения.
Озон токсичен, является сильным окислителем. Применяется для обеззараживания помещений, медицинского оборудования и воды.
1. Опишите строение молекулы озона.
2. Каким физиологическим действием обладает озон?
3. Перечислите физические свойства озона. Учитывая температуру плавления этого вещества, предложите метод разделения кислорода и озона.
4. В трех закрытых колбах находятся газы озон, кислород, хлороводород. Предложите план их распознавания.
5. Рассчитайте массу смеси, содержащей кислород и озон количеством 3 моль и 0,5 моль соответственно.
6. Как и во сколько раз изменится объем газа в результате полного превращения газообразного кислорода в озон?
7. Определите относительную плотность по водороду смеси, содержащей кислород массой 3,2 г и озон количеством 0,125 моль.
8. Составьте уравнения реакций согласно схеме:
.
9. Относительная плотность смеси озона и кислорода по воздуху равна 1,195. Определите объем такой смеси (н. у.), необходимый для полного окисления метана объемом 1 дм3.
10. В смеси кислорода и озона число молекул в 2,2 раза меньше числа атомов. Рассчитайте массу озона в этой смеси массой 100 г.
1. Аллотропной модификацией кислорода является:
2. Правильными утверждениями по отношению к озону являются:
3. Сумма коэффициентов в уравнении реакции NaI + H2O + O3 = NaOH + I2 + O2 равна:
4. Влажная йодкрахмальная бумага становится синей при контакте с:
5. Смесь озона и кислорода может иметь молярную массу (г/моль):
Исследование, описанное в статье про озон, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое озон и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Неорганическая химия
Из статьи мы узнали кратко, но содержательно про озонОтветы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Неорганическая химия
Термины: Неорганическая химия