Лекция
Привет, Вы узнаете о том , что такое 1.5. Основные законы химии. Закон постоянства состава вещества. Закон сохранения массы веществ, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое 1.5. Основные законы химии. Закон постоянства состава вещества. Закон сохранения массы веществ , настоятельно рекомендую прочитать все из категории Неорганическая химия.
Фундаментальные законы химии позволяют описывать качественный и количественный состав веществ, а также изменения состава в ходе химических превращений. Без знания этих законов невозможны химический анализ состава вещества, вычисление количеств реагентов для проведения химических реакций в промышленности и в лаборатории, определение выхода продуктов.
Закон постоянства состава вещества
Закон постоянства состава вещества был установлен французским ученым Ж. Прустом в 1801 году.
В современной формулировке закон гласит: всякое химически чистое вещество молекулярного строения независимо от способа получения имеет постоянный состав, то есть состоит из одних и тех же химических элементов, атомы которых находятся в постоянных для данного вещества количественных соотношениях.
Закон Пруста указывает на то, что состав индивидуального чистого вещества может быть описан определенной химической формулой. Например, каким бы способом ни получали углекислый газ (сжиганием угля, действием кислоты на мрамор, окислением метана), массовая доля углерода в нем составляет 27,27 %, кислорода — 72,73 %; массы углерода и кислорода соотносятся как: 27,27 : 72,73 = 3 : 8. Соотношение их количеств: . Следовательно, в веществе на один атом углерода приходится два атома кислорода, то есть химическая формула CO2.
Покажем, как определить формулу вещества в более сложных случаях (пример 1).
Пример 1. В результате анализа органического вещества установили, что массовые доли углерода, водорода и кислорода в нем соответственно равны 44,78 %, 7,46 % и 47,76 %. Определите формулу вещества.
Дано:
ω(С) = 44,78 %
ω(Н) = 7,46 %
ω(О) = 47,76 %
СxНyOz — ?
Решение
Пусть масса порции данного вещества равна 100 г, тогда массы элементов будут равны:
m(С) = 44,78 г; m(Н) = 7,46 г;
m(O) = 47,76 г, и их количества:
Индексы в химической формуле показывают соотношение как отдельных атомов, так и их количеств. Найдем соотношение количеств атомов:
х : у : z = n(С) : n(Н) : n(O) = 3,73 моль : 7,46 моль : 2,99 моль = 3,73 : 7,46 : 2,99.
Определим индексы x, y и z. Для этого каждое из найденных чисел разделим на наименьшее из них, то есть на 2,99, а затем умножим на 4 для получения целочисленных значений:
x : y : z = 1,25 : 2,5 : 1 = 5 : 10 : 4.
Следовательно, простейшая формула вещества С5Н10O4.
Ответ: С5Н10O4.
Таким образом, знание массовых долей элементов в веществе или их масс в определенной порции вещества позволяет установить формулу вещества.
В случае некоторых веществ немолекулярного строения закон постоянства состава справедлив лишь приблизительно. Их состав может в определенных пределах варьироваться в зависимости от условий синтеза или обработки вещества.

Для веществ немолекулярного строения имеются отклонения от закона, которые не могли быть выявлены в XVII–XIX веках из-за отсутствия точных методов анализа. Так, оксид железа(II) имеет состав в интервале Fe0,89O—Fe0,95O, оксид титана(III) — Ti2O2,6—Ti2O3,4. Одна из причин нарушения состава кроется в дефектах, возникающих при формировании кристаллов немолекулярных веществ. Такие соединения названы нестехиометрическими, или бертоллидами, в честь французского химика К. Бертолле. В случае крайне малых отклонений от постоянства состава соотношения атомов в соединениях практически целочисленны, а сами соединения относят к стехиометрическим и называют дальтонидами в честь Дж. Об этом говорит сайт https://intellect.icu . Дальтона — одного из основоположников атомно-молекулярного учения (например, хлорид калия, оксид кальция).
Закон сохранения массы веществ
Закон сохранения массы веществ позволяет вычислять массы веществ, вступающих в реакцию или образующихся в результате ее протекания.
Напомним, что процесс превращения одних веществ в другие без изменения общего числа и природы атомов, из которых эти вещества состоят, называют химической реакцией. Вступающие в химическую реакцию вещества — это реагенты, а образующиеся в результате химической реакции вещества — это продукты.
Протекание химических реакций подчиняется закону сохранения массы веществ: масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ.
Действие закона можно показать на следующем примере. Если закрытую колбу с небольшим количеством фосфора взвесить, а затем нагреть, то фосфор загорается ярким пламенем, а колба наполняется белым дымом. Повторное взвешивание показывает, что общая масса колбы с содержимым не изменилась (рис. 10).
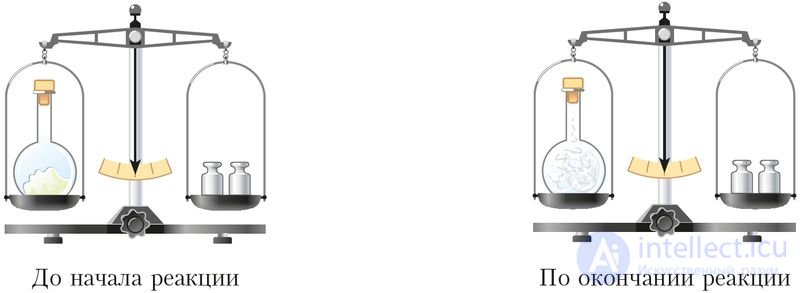
Рис. 10. Опыт, иллюстрирующий закон сохранения массы вещества
С позиции атомно-молекулярного учения закон можно объяснить тем, что при химических реакциях атомы не исчезают и не возникают вновь, их общее число остается неизменным, а значит, и суммарные массы веществ до и после реакции одинаковы.

Большой вклад в экспериментальное доказательство закона сохранения массы веществ внесли опыты русского ученого М. В. Ломоносова и французского химика А. Лавуазье (2-я половина XVIII в.) по измерению массы исходных веществ и массы получаемых из них продуктов.
Покажем, как можно использовать закон сохранения массы веществ для количественных расчетов по уравнениям реакций на примере горения метана в кислороде с образованием воды и углекислого газа.
Схема этой реакции:
Перед формулами поставим коэффициенты, которые должны уравнять число атомов реагентов и продуктов:
Это уравнение свидетельствует о том, что образование одной молекулы углекислого газа и двух молекул воды происходит, если одна молекула метана прореагирует с двумя молекулами кислорода. Коэффициенты показывают, в каком мольном соотношении реагируют вещества и образуются продукты. Так, из составленного уравнения реакции видно, что если в реакцию вступает 1 моль метана, то на его сжигание расходуется 2 моль кислорода, в результате образуются 2 моль воды и 1 моль углекислого газа.
С учетом этих количественных соотношений можно рассчитать массу (количество, объем) реагентов, необходимых для получения определенного количества продуктов, и наоборот — продуктов по исходным веществам.
Пример 2. Определите массу сульфата алюминия, образовавшегося при полном растворении алюминия массой 13,5 г в разбавленной серной кислоте.
Дано:
m(Аl) = 13,5 г
m(Al2(SО4)3) — ?
Решение
M(Al) = 27 г/моль; M(Al2(SO4)3) = 342 г/моль.
Количество алюминия, вступившего в химическую реакцию:
С учетом в уравнении реакции коэффициентов имеем:
откуда
, то есть n(Al2(SO4)3) = 0,25 моль.
Масса соли:
m(Al2(SO4)3) = n(Al2(SO4)3) ∙ M(Al2(SO4)3) = 0,25 моль ∙ 342 г/моль = 85,5 г.
Ответ: m(Al2(SO4)3) = 85,5 г.
Пример 3. При горении магния массой 1,2 г образовался его оксид массой 2 г. Определите объем кислорода (н. у.), израсходованного на горение магния.
Решить такую задачу можно как с помощью уравнения реакции, так и без него. Рассмотрим второй способ.
Дано:
m(Mg) = 1,2 г
m(MgO) = 2 г
V(O2) — ?
Решение
Согласно закону сохранения массы веществ, масса образовавшихся веществ равна массе веществ, вступивших в химическую реакцию:
Поэтому масса кислорода равна:
а его количество составляет:
Объем кислорода равен:
Ответ: V(O2) = 0,56 дм3.
Всякое химически чистое вещество молекулярного строения независимо от способа получения имеет постоянный состав.
Вещества немолекулярного строения не всегда имеют постоянный состав.
Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ.
Вопросы, задания, задачи
1. Сформулируйте основные законы химии, описывающие качественный и количественный состав веществ, а также изменения этого состава в ходе химических превращений.
2. В результате реакции разложения карбоната кальция при его прокаливании произошло уменьшение массы твердого вещества. Что, кроме массы твердого продукта, нужно измерить для подтверждения закона сохранения массы веществ?
3. Как и почему изменяется масса порции железных опилок при их хранении на воздухе?
4. Расставьте коэффициенты в схемах реакций:
5. На электронные весы поставили два стакана, содержащие питьевую соду и соляную кислоту. Затем, сняв стаканы с весов, осторожно пересыпали порошок соды в стакан с кислотой, после чего оба стакана снова поставили на весы. Как изменилось показание на табло весов?
6. Определите массу хлорида железа(III), образовавшегося при горении железа массой 2,8 г в хлоре.
7. Определите объем воздуха (н. у.), который необходим для обжига пирита FeS2 массой 1,2 кг. Обжиг пирита на воздухе протекает по схеме: FeS2 + О2 → Fe2О3 + SO2↑.
8. Чему равна масса соли, полученной при взаимодействии раствора, содержащего 10 г гидроксида натрия, с раствором, в котором содержится 10 г хлороводорода?
9. Определите химическую формулу вещества, в котором:
10. Смесь оксидов магния и кальция массой 1,04 г растворили в азотной кислоте. При этом образовалась смесь нитратов массой 3,2 г. Вычислите массу каждого из оксидов.

*Самоконтроль
1. Закон сохранения массы веществ в химических реакциях используется:
2. Правильно расставлены коэффициенты в уравнениях реакций:
3. Назовите вещества, масса которых увеличивается при прокаливании в открытом сосуде:
4. Массовые доли элементов в бинарном соединении равны. Химическая формула соединения:
5. Нестехиометрический состав могут иметь соединения:
Исследование, описанное в статье про 1.5. Основные законы химии. Закон постоянства состава вещества. Закон сохранения массы веществ, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое 1.5. Основные законы химии. Закон постоянства состава вещества. Закон сохранения массы веществ и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Неорганическая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Неорганическая химия
Термины: Неорганическая химия