Лекция
Привет, Вы узнаете о том , что такое металлы, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое металлы , настоятельно рекомендую прочитать все из категории Неорганическая химия.
Изучая этот раздел, вы расширите свои знания о мире металлов, о способах получения металлов и сплавов, областях их применения, научитесь прогнозировать и объяснять физические и химические свойства металлов и их соединений, освоите методы определения ионов многих металлов в растворах, ознакомитесь с причинами коррозии железа и возможностями ее предупреждения.
Важнейшие понятия темы: металлы , сплавы металлов, ряд активности металлов, коррозия, электролиз, основные оксиды, основания, амфотерные оксиды и гидроксиды, качественные реакции на катионы Ca2+, Ba2+, Fe2+, Fe3+.
Металлы — это кристаллические простые вещества с металлической связью между плотно упакованными атомами.
В таблице периодической системы металлы расположены левее условной ступенчатой линии (см. рис. 61). К металлам относятся s-элементы (кроме H и He), часть p-элементов и все d- и f-элементы.
У атомов металлов число электронов на внешнем слое в основном составляет от 1 до 3. Исключением являются всего несколько металлов: Ge, Sn, Pb (4 электрона); Sb, Bi (5 электронов); Po (6 электронов). В периоде у атомов металлов больше радиус, чем у неметаллов, так как малы силы кулоновского взаимодействия электронов с ядром.

Напомним, что по структуре кристаллов и электрофизическим свойствам германий и одна из аллотропных модификаций олова являются полупроводниками.
Электронные конфигурации внешней электронной оболочки атомов s-элементов 2-го и 3-го периодов, а также p-элемента 3-го периода Al приведены в главе 2, таблице 6 и в Приложении 1. Атомы элементов IА- и IIА-групп 2–7-го периодов имеют электронную конфигурацию ns1 и ns2 соответственно. Металлы — это и p-элементы IIIА–VIА-групп 3–7-го периодов (Al, Ga, In, Tl, Sn, Pb, Sb, Bi, Po); их электронные конфигурации ns2np1, ns2np2, ns2np3, ns2np4.
В периодической системе в каждом периоде, начиная с 4-го и заканчивая 7-м, имеется по 10 d-элементов, у атомов которых с ростом порядкового номера последовательно заполняются пять d-орбиталей.
Обратим внимание, что энергия 3d-подуровня выше, чем 4s-подуровня. Поэтому d-электроны могут принимать участие в образовании химических связей, то есть атомы d-элементов имеют большее число валентных электронов по сравнению с атомами s- и p-элементов, относящихся к металлам.
Знакомые вам примеры d-элементов — Fe (элемент VIIIB-группы 4-го периода, формула электронной конфигурации 1s22s22p63s23p63d64s2), а также Cu (элемент IB-группы 4-го периода, формула электронной конфигурации 1s22s22p63s23p63d104s1).
Начиная с 6-го периода в периодической системе появляются f-элементы, которые объединены в семейства по 14 элементов (за счет сходных химических свойств) и носят особые названия лантаноидов и актиноидов.
При образовании металлической связи атомы металлов легко обобществляют свои валентные электроны. Электроны принадлежат не отдельным атомам, а являются общими для всех атомов и свободно перемещаются по всему кристаллу (см. гл. 3, рис. 26). Металлическая связь присуща металлам в жидком и твердом агрегатном состояниях.
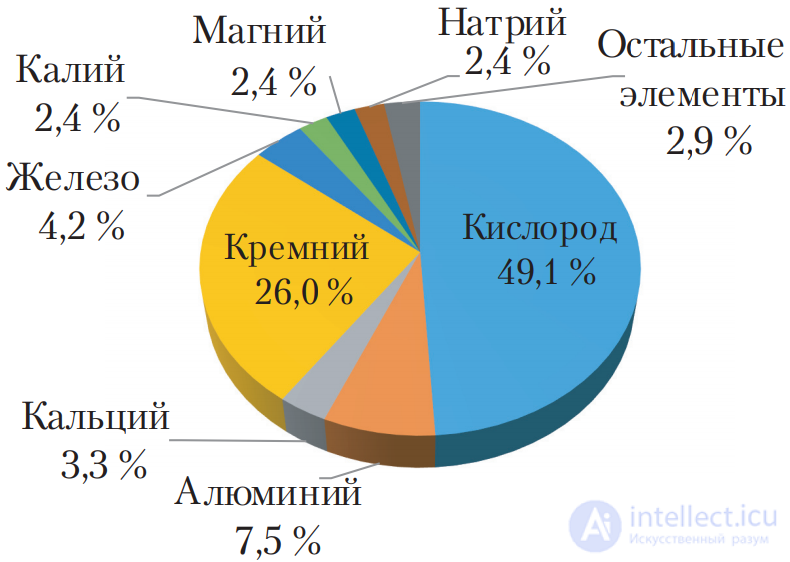
Рис. 102. Распространенность металлов в земной коре
На долю металлов приходится 25 % массы земной коры и 3–5 % массы тела человека. В земной коре самым распространенным металлом является алюминий (рис. 102).
Формы нахождения металлов в природе соотносятся с химической активностью их простых веществ. Наиболее активные металлы находятся в природе, как правило, в виде солей — хлоридов, сульфатов, карбонатов, фосфатов, силикатов (NaCl, KCl, MgSO4 · 7H2O, CaCO3, Ca3(PO4)2), алюмосиликатов. Металлы средней активности представлены в природе чаще всего оксидами и сульфидами (Fe2O3, Fe3O4, ZnS, CuFeS2, PbS, Cr2O3). Об этом говорит сайт https://intellect.icu . Металлы низкой активности (Сu, Ag, Au, Pt) встречаются в природе в свободном состоянии. Многие минералы имеют сложный состав и включают катионы двух-трех разных металлов и анионы разных кислотных остатков неорганических кислот и гидроксильные группы (Приложение 2).
В крови человека обнаружено более 60 химических элементов-металлов. В организме человека присутствуют макроэлементы — калий, кальций, натрий, магний, а в меньших количествах микроэлементы — алюминий, железо, марганец, медь, цинк и другие.
Для металлов характерны высокие тепло- и электропроводность, пластичность (ковкость) и металлический блеск (§ 11, табл. 8). Отличительной чертой электропроводности металлов является ее зависимость от температуры: с ростом температуры их электропроводность уменьшается. При этом она в 1014 раз и более превышает электропроводность диэлектриков. Наиболее высокой электро- и теплопроводностью обладают серебро, золото, медь и алюминий, самой низкой — ртуть и висмут (рис. 103).
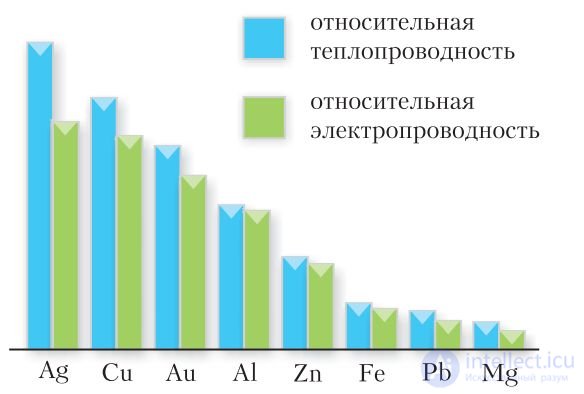
Рис. 103. Тепло- и электропроводность металлов

Рис. 104. Ковка металла как демонстрация его пластичности
Пластичность (ковкость) металлов выражается в их способности изменять форму при давлении, вытягиваться в проволоку, прокатываться в тонкие листы (рис. 104). Пластичность металлов объясняется тем, что плотно уложенные слои атомов металла могут скользить относительно друг друга, не разрушая объединяющие их химические связи (см. § 16, рис. 39). По пластичности металлы подразделяют на высокопластичные (по убыванию) — Au, Ag, Pb, Cu, Fe, Ti, Sn, Al; пластичные — Mg, Zn, Mo, W; хрупкие — Cr, Mn, Sb.
По агрегатному состоянию при комнатной температуре все металлы, за исключением ртути, — твердые вещества с кристаллической структурой. Температуры плавления металлов лежат в диапазоне от –39 °C (ртуть) до 3422 °C (вольфрам) (рис. 105).
По плотности металлы делят на тяжелые и легкие. Примерами легких металлов служат калий (ρ = 0,9 г/см3), алюминий (ρ = 2,7 г/см3). К тяжелым относятся металлы, расположенные в периодической системе за железом, например свинец, ртуть, золото. У тяжелых металлов плотность больше 7,8 г/см3. Так, плотность золота составляет 19,3 г/см3.
Самые твердые металлы — вольфрам, хром, титан, молибден (рис. 106). Твердость хрома и вольфрама приближается к твердости корунда (Приложение 2). К мягким металлам относятся, например, натрий и калий. Их слитки можно разрезать ножом.
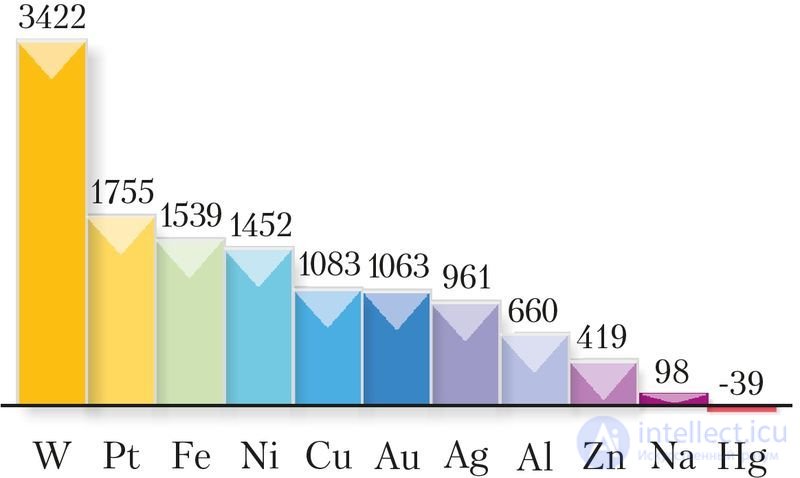
Рис. 105. Температуры плавления металлов
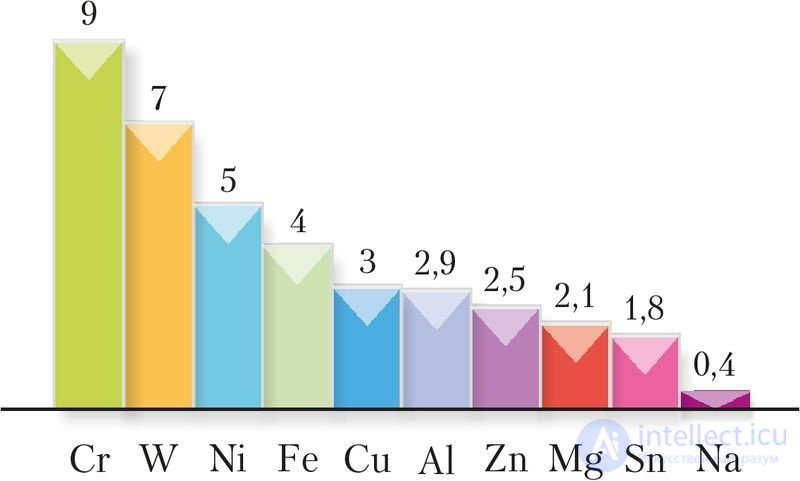
Рис. 106. Относительная твердость металлов по шкале Мооса
Полированная поверхность металлов обладает характерным металлическим блеском. Благодаря этому свойству тонкие слои серебра или алюминия на гладкой поверхности, например стекла, используют для изготовления зеркал.
Сплавы металлов, их состав, свойства, применение
В технике и в быту, как правило, используют не индивидуальные металлы, а их сплавы. Наиболее часто сплавы получают металлургическим путем, расплавляя механические смеси двух и более металлов или смеси металлов с неметаллами. Полученные расплавы выдерживают при определенной температуре для протекания взаимодействия компонентов, а затем кристаллизуют.
Под металлическими сплавами понимают материалы, имеющие металлические свойства и состоящие из двух или большего числа химических элементов, из которых хотя бы один является металлом.
Свойства сплава зависят от природы и количественного соотношения компонентов, метода получения и обработки. Сопоставим такие свойства индивидуальных металлов и сплавов, как температура плавления, твердость и плотность.
Сплавы часто отличаются более низкими температурами плавления по сравнению с индивидуальными металлами. Например, чистый свинец плавится при температуре +327,5 °С, а чистое олово — при +232 °С. Сплав на основе олова, содержащий 36 % свинца, имеет температуру плавления +181 °С. Сплавы обычно тверже чистого металла, их электро- и теплопроводность меньше. Многие сплавы известны человеку с древних времен. Первые металлические предметы, которые удалось найти археологам, были сделаны из бронзы — сплава, который дал название целой эпохе развития человечества. Плотность сплавов обычно имеет значение промежуточное между плотностями индивидуальных компонентов сплава.
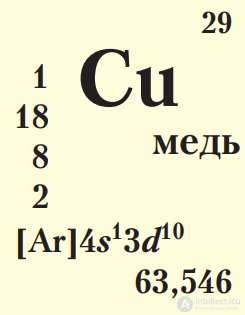
Бронзами называют сплавы меди с другими металлами, например оловом, железом, алюминием и др., кроме цинка и никеля. Наиболее распространены оловянистые бронзы — сплавы Cu—Sn, в которых содержание олова достигает нескольких процентов, а иногда и выше. Сплав меди с цинком с разным содержанием цинка, иногда даже до 50 %, называют латунью. Благодаря устойчивости к механическому истиранию и высокой коррозионной стойкости бронзу и латунь применяют для изготовления деталей машин и приборов, различной фурнитуры, труб. Бронзу используют для литья скульптур и памятников. Нам всем знакомы бронзовые люстры и статуэтки, латунные краны, самовары, дверные ручки (рис. 107).
На данном этапе развития цивилизации наиболее широко применяемый металл — железо, но его не используют в чистом виде. Твердость чистого железа невелика. Кроме того, оно быстро окисляется на воздухе, особенно во влажной атмосфере, от чего изделия из него приходят в негодность. Поэтому используют сплавы железа, содержащие углерод и примеси других металлов. При содержании углерода более 2 % по массе — это чугуны, менее 2 % — стали.
Благодаря хорошим литейным качествам, прочности, малому коэффициенту трения и многим другим полезным качествам чугун используют для изготовления деталей арматуры, оснований станков, подшипников, котлов и многих других изделий машино-, тракторо- и станкостроения. Сталь в сравнении с чугуном более пластична, прочнее, тверже, легче обрабатывается механически. Некоторые ее сорта, содержащие примеси Cr, Ni, Mo, Ti, более коррозионностойкие. Сплавы железа с никелем, хромом и другими металлами (до нескольких процентов), содержащие менее 2 % углерода, незаменимы при изготовлении строительных конструкций, деталей машин, рельсов, режущего инструмента, арматуры (рис. 107).

Рис. 107. Изделия из сплавов металлов
Дюралюминий — сплав алюминия (94 %) с медью, магнием и марганцем — основной конструкционный материал в авиации, космонавтике, производстве скоростных поездов, автомобилей и других областях промышленности, для которых принципиальную роль играет минимальная масса конструкции. Этот сплав отличается не только легкостью, но и прочностью (см. рис. 107).
Сплав вольфрама с кобальтом и углеродом (победит) по твердости близок к алмазу. Из него изготавливают сверхпрочные инструменты для металлообработки и бурения горных пород, сверл по бетону.
Чистое золото — мягкий металл, поэтому в ювелирных изделиях используют его более твердые сплавы, например, с медью, никелем. Добавление в золото других металлов изменяет не только его механические свойства, но и цвет. Например, при содержании палладия более 10 % золото окрашивается в белый цвет с легким телесным оттенком.
Металлы — это кристаллические вещества с металлической связью между плотно упакованными атомами.
Для металлов характерны высокие тепло- и электропроводность, высокая пластичность (ковкость) и металлический блеск.
Металлические сплавы — это материалы, имеющие металлические свойства и состоящие из двух или большего числа химических элементов, из которых хотя бы один является металлом.
| Металлы(сплавы) | Плотность, г/см3 | Металлы (сплавы) | Плотность, г/см3 |
| Алюминий | 2,7 | Медь | 8,96 |
| Сталь | 7,6–7,9 | Серебро | 10,5 |
| Бронза | 8,7–9,0 | Золото | 19,3 |
| Никель | 8,9 | Платина | 21,5 |
1. В земной коре существуют только в виде соединений:
2. Наиболее характерными свойствами металлов считают:
3. Число металлов больше числа неметаллов в группе, если электронная конфигурация атомов элементов в ней:
4. Правильными являются утверждения:
5. Массовая доля цинка в латуни — 45 %. Для получения 20 кг латуни без примесей требуется:
Исследование, описанное в статье про металлы, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое металлы и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Неорганическая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Неорганическая химия
Термины: Неорганическая химия