Лекция
Привет, Вы узнаете о том , что такое гидролиз солей, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое гидролиз солей , настоятельно рекомендую прочитать все из категории Неорганическая химия.
В водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие нередко приводит к реакции гидролиза (от др.-греч. hydro — вода + lysis — разложение).
Гидролиз — это химическая реакция взаимодействия вещества с водой, при которой происходит разложение молекул этого вещества и воды с образованием новых соединений.
Гидролиз соединений различных классов — солей, углеводов, галогеналканов, белков, сложных эфиров (в том числе жиров) и др. существенно различается. С гидролизом галогеналканов, белков (полипептидов), ди- и полисахаридов (на примере сахарозы, крахмала и целлюлозы), а также сложных эфиров вы познакомились в курсе органической химии. В этом разделе мы рассмотрим гидролиз неорганических веществ — солей.
гидролиз солей — это обменное взаимодействие между молекулами воды и катионами или анионами соли, приводящее к образованию слабых электролитов.
Анионы слабых кислот, взаимодействуя с катионами водорода, могут образовывать слабо диссоциирующие молекулы кислоты. Катионы слабых оснований, взаимодействуя с гидроксид-ионами, могут образовывать малодиссоциирующие основания.
Среда в водных растворах гидролизующихся солей может быть кислой (pH < 7,0) или щелочной (pH > 7,0) потому, что в растворе соли в результате гидролиза появляется избыток ионов Н+ или ОН–.
Отличие среды раствора соли от нейтральной — один из признаков гидролиза соли. Насколько велико это отличие, а также кислым или щелочным является раствор соли, зависит от силы основания и кислоты, из которых эта соль образуется по реакции нейтрализации.
Классификация солей по их подверженности реакции гидролиза
Любая соль может быть представлена как продукт реакции нейтрализации (от лат. neuter — ни тот, ни другой) при взаимодействии кислоты и основания. Кислоты и основания могут быть как сильными, так и слабыми электролитами.
Реакция нейтрализации — это реакция обмена между кислотой и основанием с образованием соли и воды:
KOH + HF = KF + H2O.
Кислоты и основания как электролиты различаются по своей силе. Например, соли аммония можно рассматривать как образованные в реакции с участием слабого основания — гидрата аммиака NH3 · H2O. Соль KF образована сильным основанием KОН и слабой кислотой HF, сульфид аммония — слабым основанием и слабой кислотой.
В зависимости от силы основания и кислоты можно выделить четыре типа солей (рис. 60.1).
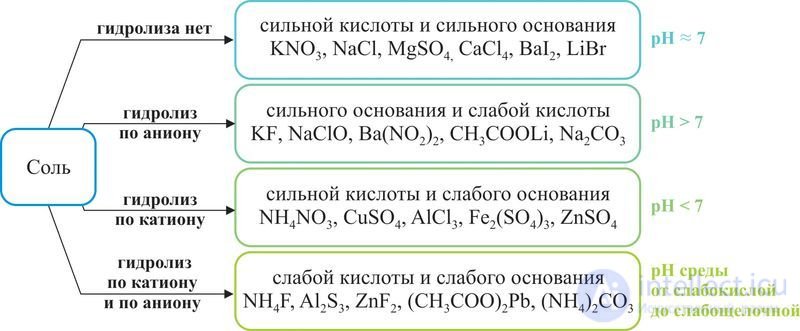
Рис. 60.1. Классификация солей по их подверженности реакции гидролиза
Рассмотрим гидролиз солей всех четырех типов.
Соли, образованные сильным основанием и слабой кислотой. В качестве примера можно привести ацетат натрия CH3COONa. Эта соль образована сильным основанием NaОН и слабой кислотой CH3COOH:
NaОН + CH3COOH = CH3COONa + H2O.
В водном растворе ацетата натрия происходят два процесса:
а) полная диссоциация сильного электролита — соли CH3COONa на катион и анион:
CH3COONa → Na+ + CH3COO–;
б) взаимодействие ацетат-ионов с молекулами воды с образованием слабого электролита — уксусной кислоты:
CH3COO– + H2О CH3COOH + ОН–.
Избыток анионов ОН– накапливается в растворе и создает слабощелочную среду, что свидетельствует о протекании гидролиза по аниону CH3COO–.
Уравнение гидролиза ацетата натрия показывает, что:
Равновесие гидролиза в данном примере сильно смещено влево — в сторону образования исходных веществ, так как вода — значительно более слабый электролит, чем уксусная кислота СH3COOH.
Гидролиз является реакцией, обратной нейтрализации.
Примеры анионов слабых кислот, соли которых гидролизуются водой:
Рассмотрим гидролиз карбоната натрия Na2СO3 — соли сильного основания NaOH и слабой двухосновной кислоты H2CO3. Гидролиз протекает по аниону в соответствии с уравнением в полной ионной форме:
2Na+ + + H2O
2Na+ +
+ OH–.
Уравнение в сокращенной ионной форме выглядит так:
+ H2O
+ OH–.
В растворе Na2СO3 образуется избыток гидроксид-анионов и создается щелочная среда. Об этом говорит сайт https://intellect.icu . Раствор Na2CO3 с концентрацией 0,1 моль/дм3 имеет рН около 11,5.
Соли, образованные сильной кислотой и слабым основанием. Рассмотрим гидролиз хлорида аммония NH4Cl. Это соль сильной кислоты — HCl и слабого основания — гидрата аммиака NH3 · H2O.
В водном растворе соли происходят два процесса:
а) полная диссоциация сильного электролита — соли NH4Cl:
NH4Cl → + Cl–;
б) взаимодействие ионов аммония с молекулами воды с образованием слабого электролита — гидрата аммиака NH3 · H2O:
+ H2O
NH3 · H2O + H+.
Это уравнение показывает, что:
В реакцию с водой могут вступать и многозарядные катионы: двухзарядные Ni2+, Cu2+, Zn2+, Mn2+, Fe2+, Co2+, Pb2+ (кроме катионов Mg2+, Ca2+, Sr2+, Ba2+), трехзарядные Fe3+, Al3+, Сr3+.
Рассмотрим гидролиз нитрата меди(II) Сu(NO3)2. Это соль сильной кислоты — HNO3 и слабого основания — Cu(OH)2.
В этом случае принято говорить, что гидролиз протекает по катиону Cu2+. Уравнение гидролиза в полной ионной форме:
Cu2+ + + H2O
Cu(OH)+ +
+ H+.
Уравнение гидролиза в сокращенной ионной форме:
Cu2+ + H2O Cu(OH)+ + H+.
Продуктами гидролиза являются основная соль Cu(OH)NO3 и азотная кислота HNO3.
Среда водного раствора нитрата меди(II) кислая (pH ≈ 4,5), поскольку в растворе имеется избыток катионов Н+.
Соли, образованные слабым основанием и слабой кислотой. Такие соли подвергаются гидролизу и по катиону, и по аниону. При этом появляющиеся при гидролизе по катиону ионы Н+ связываются образующимися при гидролизе по аниону ионами ОН–, что усиливает гидролиз. Нередко эта реакция необратима. Например, сульфид алюминия Al2S3 в воде подвергается необратимому гидролизу с образованием нерастворимого гидроксида алюминия и газообразного сероводорода:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑.
Поэтому сульфид алюминия Al2S3 нельзя получить реакцией обмена между водными растворами двух солей, например, нитрата алюминия Al(NO3)3 и сульфида калия K2S.
Возможны и другие случаи необратимого гидролиза. Их нетрудно предсказать, ведь для необратимости процесса необходимо, чтобы хотя бы один из продуктов гидролиза уходил из сферы реакции. Приведем пример совместного необратимого гидролиза катионов Al3+ и анионов :
2Al(NO3)3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 6NaNO3 + 3CO2↑.
Для солей, подвергающихся необратимому гидролизу, в таблице «Растворимость кислот, оснований и солей в воде» вы найдете примечание: «не существуют в водном растворе».
Подведем итог тому, что вы узнали о гидролизе и по катиону, и по аниону:
Обобщим информацию о гидролизе различных катионов и анионов в составе средних солей по катионам и анионам в таблице 19.1.
Таблица 19.1. Гидролиз катионов и анионов
| Состав соли | Ионы, по которым не идет гидролиз | Ионы, по которым идет гидролиз в порядке усиления | Ионы, по которым идет сильный гидролиз |
| Катионы | K+, Na+, Li+, Ba2+, Sr2+, Ca2+, Mg2+, Ag+ | Mn2+, Co2+, Zn2+, Ni2+, Fe2+, Pb2+, Cu2+, Be2+ | Al3+, Cr3+, Sn2+, Fe3+ |
| Анионы | Cl–, Br–, I–, |
F–, |
Не гидролизуются: растворимые галогениды (кроме фторидов), нитраты, перхлораты, сульфаты и перманганаты щелочных и щелочноземельных металлов.
Отметим, что реакции обратимого гидролиза подчиняются принципу Ле Шателье, поэтому гидролиз соли можно как усилить, так и ослабить.
Гидролиз солей обусловлен протеканием реакций ионного обмена с участием молекул воды и ионов соли с образованием слабого электролита.
Гидролиз по аниону, как правило, обратим и протекает в небольшой степени. При разбавлении растворов солей равновесие гидролиза смещается вправо, реакция среды в растворах солей слабых кислот слабощелочная, изредка сильнощелочная.
Гидролиз по катиону, как правило, обратим и протекает в небольшой степени. При разбавлении растворов солей равновесие гидролиза смещается вправо, реакция среды в растворах солей слабых оснований слабокислая, изредка сильнокислая.
Гидролиз одновременно по катиону и аниону протекает в значительно большей степени, чем гидролиз этих ионов по отдельности. Положение равновесия реакции гидролиза по катиону и аниону не зависит от концентрации соли, а реакция среды раствора не сильно отклоняется от нейтральной.
Соли слабых кислот и оснований необратимо гидролизуются по катиону и аниону при удалении из раствора одного из продуктов реакции в виде газа.
1. Соли каких типов подвержены гидролизу?
2. Какие из солей, формулы которых: K3PO4, Al2(SO4)3, MgSO4, NH4NO3, Pb(NO3)2, Na2CO3, подвергаются гидролизу по катиону? Составьте уравнения гидролиза этих солей, укажите реакцию среды.
3. Какие из солей, формулы которых: Na2S, AlCl3, K2SO3, Cr2(SO4)3, (CH3COO)2Ba, AgF, Mg(NO3)2, Na2SiO3, KMnO4, Na3PO4, подвергаются гидролизу по аниону? Составьте уравнения гидролиза этих солей, укажите реакцию среды и окраску лакмуса в растворе.
4. Реакция нейтрализации сильных кислот или оснований протекает с выделением теплоты. Используя принцип Ле Шателье, обоснуйте, почему при нагревании равновесие гидролиза смещается вправо.
5. Степень диссоциации воды возрастает в 7,5 раза при ее нагревании от 25 °С до 100 °С и уменьшается в 3 раза при охлаждении воды от 25 °С до 0 °С. Дайте объяснение этим фактам с учетом того, что диссоциация воды — эндотермическая реакция. Куда смещается равновесие гидролиза при повышении и понижении температуры и как оно зависит от степени диссоциации воды?
6. Какие из приведенных солей подвергаются гидролизу и по катиону, и по аниону: NH4F, (CH3COO)3Al, (CH3COO)2Cu, (NH4)2CO3, KNO2, AgNO3, Na3PO4, CrCl3? Составьте уравнения гидролиза этих солей (все реакции обратимы) в полной ионной форме.
7. Добавление каких из указанных веществ к раствору сульфата железа(III) усилит гидролиз соли: НСl, NH3, HNO3, Н2O, K2CO3? Дайте объяснение.
8. Стеарат натрия C17H35COONа (твердое мыло) гидролизуется в воде по аниону. Составьте уравнение гидролиза в полной и сокращенной ионной формах и укажите, какую среду имеет раствор. Как влияют температура и разбавление раствора мыла на равновесие реакции гидролиза? Почему сода Na2CO3 препятствует гидролизу мыла?
9. Очистка питьевой воды от взвешенных нерастворимых примесей проводится методом коагуляции — слипания мелких частиц с образованием более крупных хлопьев, которые выпадают в осадок. Коагуляция включает три стадии: смешение реагентов с очищаемой водой, образование хлопьев и осаждение хлопьев вместе с загрязнителем. Для проведения коагуляции воду подщелачивают содой и добавляют растворимую соль алюминия. В воде соль алюминия превращается в Al(OH)3 по схеме одновременного гидролиза по катиону Al3+ и аниону . Образующийся Al(OH)3 представляет собой белые хлопья с большой поверхностью. Хлопья захватывают взвешенные частички, бактерии, ионы тяжелых металлов, затем укрупняются и оседают вместе с загрязнениями на дно отстойника. Напишите уравнение реакции между сульфатом алюминия и карбонатом натрия в молекулярной, полной и сокращенной ионной формах.
10. При сливании растворов FeCl3 и Na2CO3 выпадает осадок бурого цвета и наблюдается выделение газа. Какое вещество выпадает в осадок и какой газ выделяется? Напишите уравнение протекающей реакции и рассчитайте объем (н. у.) выделившегося газа, если к раствору Na2CO3 объемом 100 см3 с массовой долей растворенного вещества 7,85 % и плотностью 1,080 г/см3 прилили избыток раствора FeCl3.
1. Щелочную среду имеют растворы солей:
2. рН >7 имеют водные растворы:
3. Лакмус окрасит в красный цвет раствор:
4. Равновесие реакции гидролиза в растворе медного купороса
Cu2+ + H2O Cu(OH)+ + H+
можно сместить влево («подавить гидролиз»):
5. Не образуется соль при сливании растворов:
Исследование, описанное в статье про гидролиз солей, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое гидролиз солей и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Неорганическая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Неорганическая химия
Термины: Неорганическая химия