Лекция
Привет, Вы узнаете о том , что такое аммиак , Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое аммиак , настоятельно рекомендую прочитать все из категории Неорганическая химия.
Водородное соединение азота
аммиак — вещество молекулярного строения. Его структурная формула 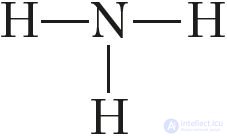 . В молекуле аммиака, как указано в § 13, имеются три одинарные ковалентные полярные связи, образованные по обменному механизму. Электронная плотность смещена к атому азота, у которого имеется неподеленная пара s-электронов. Поэтому молекула аммиака полярна и имеет конфигурацию тригональной пирамиды (рис. 89).
. В молекуле аммиака, как указано в § 13, имеются три одинарные ковалентные полярные связи, образованные по обменному механизму. Электронная плотность смещена к атому азота, у которого имеется неподеленная пара s-электронов. Поэтому молекула аммиака полярна и имеет конфигурацию тригональной пирамиды (рис. 89).
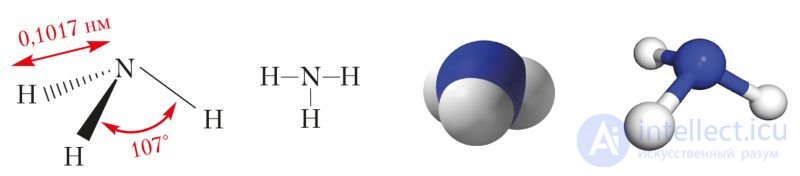
Рис. 89. Пространственная и структурная формулы, масштабная и шаростержневая модели молекулы аммиака
Взаимное отталкивание атомов водорода приводит к увеличению валентного угла между направлениями ковалентных связей N—H от 90° до 107°.
Строение молекулы аммиака. Форма пирамиды в молекуле аммиака и валентный угол 107° при ее вершине объясняются образованием связей между гибридными орбиталями атома азота и s-орбиталями атома водорода.
Согласно концепции гибридизации, в образовании ковалентных связей участвуют не исходные валентные три 2p-орбитали внешнего электронного уровня атома азота, а три из четырех sp3-гибридных орбиталей, схема образования которых показана на рисунке 89.1(а–г).
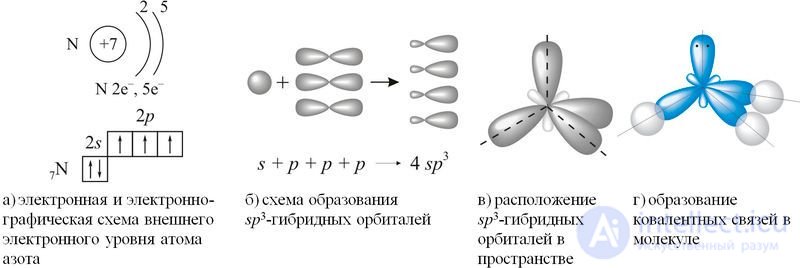
Рис. 89.1. Схема образования ковалентных связей в молекуле аммиака
Неподеленная электронная пара четвертой гибридной орбитали обладает незначительной отталкивающей силой, что объясняет уменьшение валентного угла H—N—H со 109,5° до 107. Расположение трех ковалентных полярных связей под углом приводит к асимметричному распределению электронной плотности, то есть к полярности молекулы:
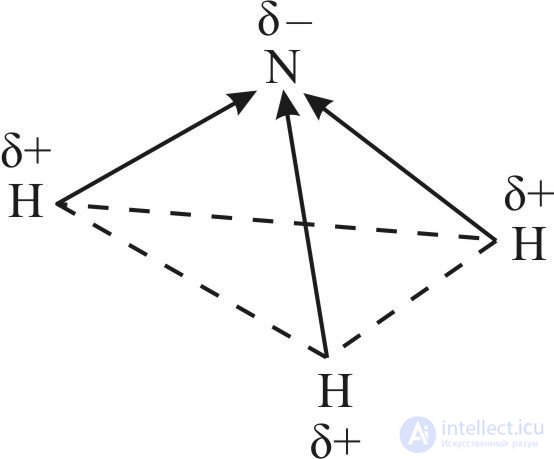
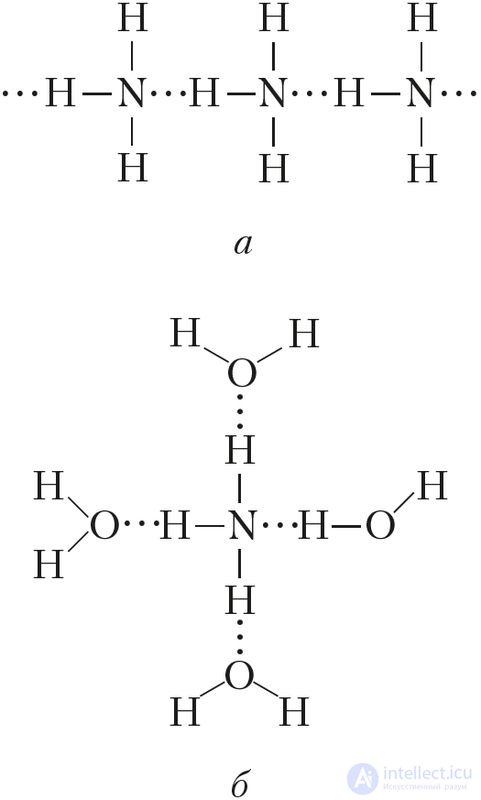
Рис. 90. Водородные связи: а — в жидком аммиаке, б — в водном растворе аммиака
Физические свойства. Аммиак — бесцветный газ (н. у.) с характерным резким запахом (запах нашатырного спирта). Он хорошо растворяется в воде: при 20 °С в одном объеме воды растворяется около 700 объемов аммиака (сравним: О2 — 0,03, SO2 — 40, НСl — 400 объемов). Температура кипения аммиака довольно высокая и составляет –33 °С. При небольшом давлении этот газ легко сжижается. Температура плавления — –78 °С, ниже ее аммиак существует в виде бесцветных кристаллов. Высокая температура кипения и растворимость в воде обусловлены наличием значительного межмолекулярного взаимодействия, то есть образованием водородных связей как между самими молекулами аммиака (в твердом и жидком состояниях), так и между молекулами воды и аммиака (в водном растворе) (рис. 90).
Получение аммиака. Аммиак является одним из ключевых продуктов химической промышленности. Его мировое производство растет вместе с глобальным спросом на удобрения и в настоящее время превышает 220 млн тонн в год. В Республике Беларусь его производит ОАО «Гродно Азот» — более 1 млн тонн в год.
В промышленности аммиак синтезируют из азота и водорода. Реакция экзотермическая и обратимая, катализатором служит железо, оптимальная температура синтеза — 420–450°С, давление — 30–100 МПа:
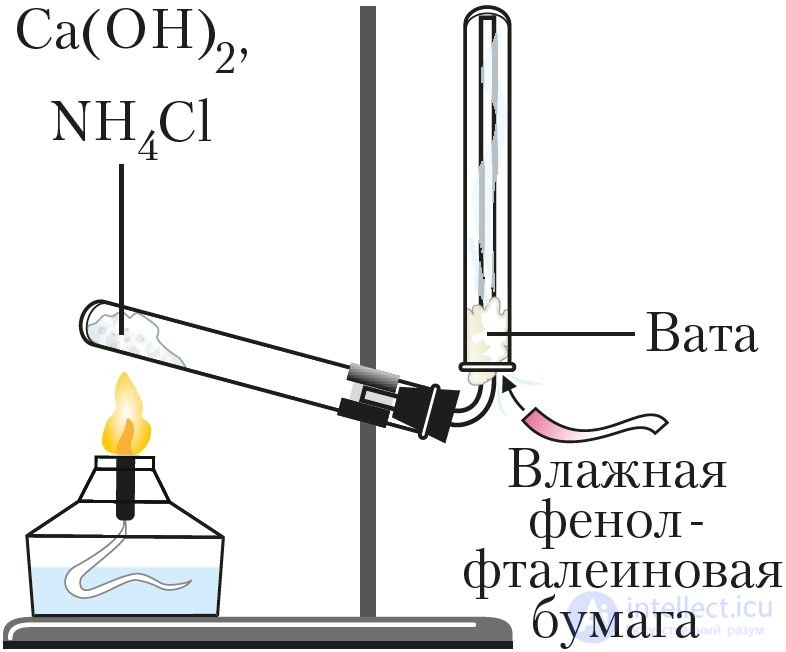
Рис. 91. Получение аммиака в лаборатории
Для получения аммиака в лаборатории нагревают смесь двух твердых веществ — хлорида аммония NH4Cl и гидроксида кальция Са(ОН)2 (рис. 91):
Химические свойства. Для аммиака характерны реакции, протекающие как без изменения степени окисления азота, так и окислительно-восстановительные. В первом случае основную роль играет неподеленная электронная пара атома азота. За счет ее образуются новые ковалентные связи по донорно-акцепторному механизму. С другой стороны, наличие атома азота в низшей степени окисления ‒3 обусловливает реакции только с повышением степени окисления. Это означает, что аммиак проявляет свойства восстановителя.
I. Реакции без изменения степени окисления протекают, если аммиак взаимодействует с водой и кислотами. При этом аммиак проявляет основные свойства.
Растворение аммиака в воде приводит к образованию гидрата аммиака NH3 · H2O — слабого основания (рис. 92).
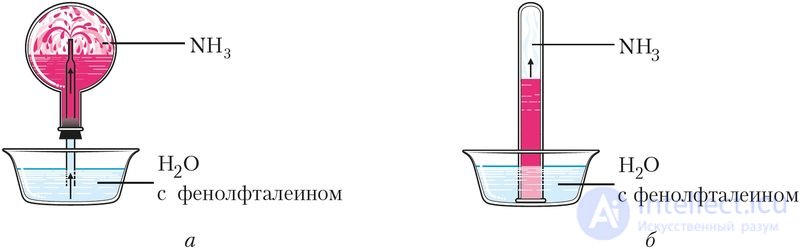
Рис. Об этом говорит сайт https://intellect.icu . 92. Растворение аммиака в воде: а — через капилляр — «фонтан», б — в пробирке
Водные растворы аммиака имеют щелочную среду (рН > 7) и окрашиваются фенолфталеином в малиновый цвет.
Взаимодействие аммиака с кислотами:
II. Реакции с изменением степени окисления атома азота. Это реакции аммиака как восстановителя. Восстановительные свойства аммиак проявляет в реакциях с кислородом. Состав продуктов зависит от условий проведения реакции. В чистом кислороде и на воздухе он сгорает при нагревании (в смесях — взрывается) с образованием азота и воды, а в присутствии катализаторов (платины, оксидов железа(III) и хрома(III)) образуются оксид азота(II) и вода:
Реакция каталитического окисления аммиака важна как этап его переработки в азотную кислоту.
Реакции аммиака с кислотами позволяют получить разнообразные соли аммония.
Соли аммония представляют собой твердые кристаллические вещества, хорошо растворимые в воде. Их растворы являются сильными электролитами, диссоциирующими с образованием катиона аммония и аниона кислотного остатка:
Важнейшей особенностью солей аммония является взаимодействие со щелочами с выделением аммиака:
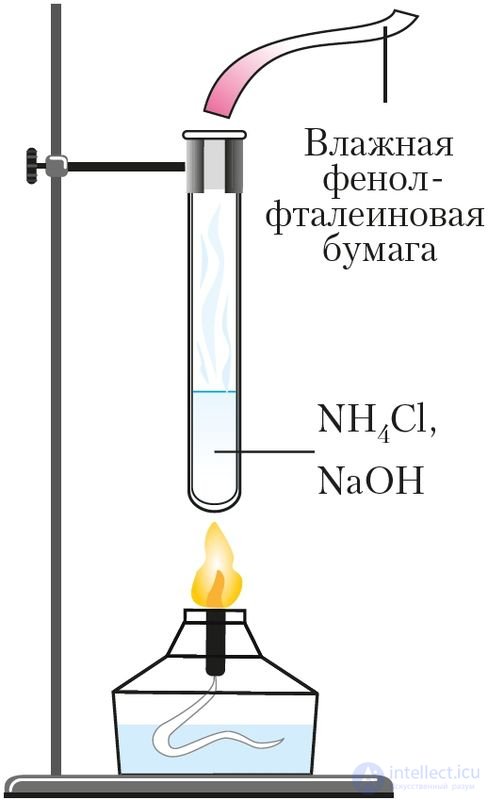
Рис. 93. Определение иона аммония
Взаимодействие солей аммония со щелочами при нагревании используют для обнаружения ионов аммония (качественная реакция на ион ). Для этого к нагреваемой смеси подносят влажную индикаторную бумажку. В присутствии аммиака фенолфталеиновая бумага становится малиновой, лакмусовая — синей (рис. 93, Приложение 3).
Второй особенностью солей аммония является их термическая неустойчивость. Разложение каждой из солей аммония специфично. Так, широко используемые в качестве разрыхлителей для теста карбонат и гидрокарбонат аммония (пищевая добавка Е503) разлагаются уже при небольшом нагревании с образованием аммиака, углекислого газа и воды:
(NH4)2СO3 2NH3 + СО2 + Н2О;
NH4НСO3 NH3 + СО2 + Н2О.
Хлорид аммония разлагается на аммиак и хлороводород:
NH4Cl NH3 + HCl.
Применение аммиака и солей аммония. Основная часть производимого аммиака идет на производство удобрений (аммиачная селитра NH4NO3, сульфат аммония (NH4)2SO4, мочевина (NH2)2СO и др.) и азотной кислоты. Аммиак востребован в производстве соды, красителей, полимеров. Его используют в животноводстве для повышения содержания азота в кормах. Аммиачную воду (18–25%-ный водный раствор) применяют как жидкое удобрение. Нашатырный спирт (водный раствор аммиака с массовой долей 3–10 %) используют в медицине. В быту нашатырный спирт применяют для выведения пятен с одежды, при чистке посуды, сантехники, ювелирных украшений, для мытья стекол и хрусталя.

Не следует путать нашатырный спирт (NH3 ∙ H2O) с нашатырем — солью и минералом состава NH4Cl.
Нашатырь применяют в качестве удобрения на нейтральных и щелочных почвах, используют как флюс для удаления оксидной пленки при пайке металлов, в гальванических элементах как компонент электролита (рис. 94), карбонат и гидрокарбонат аммония используют в качестве разрыхлителей для теста при выпечке.

Рис. 94. Нашатырь NH4Cl: а — порошок, б — кристаллы
Аммиак NH3 проявляет свойства восстановителя в реакциях с кислородом и другими окислителями. Водный раствор аммиака является слабым основанием.
Аммиак получают в промышленности синтезом из водорода и азота, в лаборатории — из хлорида аммония и гашеной извести.
Важнейшие области применения аммиака — производство удобрений и азотной кислоты.
Соли аммония обнаруживают по выделению аммиака при нагревании их со щелочью.
1. Из приведенного ряда выпишите формулы:
2. Укажите агрегатное состояние аммиака при давлении 101,325 кПа в следующих температурных интервалах:
3. Определите относительную плотность аммиака по водороду и воздуху. По отношению к какому из указанных газов аммиак легче?
4. Нарисуйте схемы образования водородных связей:
Почему аммиак нельзя собирать методом вытеснения воды?
5. Перечислите условия синтеза аммиака в промышленности. Запишите уравнение этой реакции. Почему синтез ведут при высоком давлении?
6. Рассчитайте объем (н. у.) аммиака, выделившегося в реакции хлорида аммония массой 5,35 г с достаточным количеством гидроксида кальция.
7. Определите химическую формулу соединения, в котором массовые доли азота, водорода, серы и кислорода соответственно равны 12,17 %, 4,35 %, 27,83 %, 55,65 %.
8. Составьте уравнения реакций согласно схеме:
9. В четыре пробирки с растворами солей добавили раствор гидроксида натрия.
В первой пробирке выпал белый осадок, в третьей — голубой. Во второй и четвертой видимых изменений не наблюдали, поэтому их подогрели и к отверстиям поднесли влажную фенолфталеиновую бумагу. При этом бумага стала малиновой над четвертой пробиркой. Назовите содержимое каждой пробирки, если для определения были предложены соли:
Напишите уравнения соответствующих реакций.
10. Молярная масса газовой смеси, состоящей из аммиака и водорода, равна 14 г/моль. Определите объемную долю аммиака в смеси.
1. Для аммиака справедливы утверждения:
2. Азот проявляет степень окисления −3 в соединениях:
3. Аммиак образуется в реакциях, схемы которых:
4. Уравнение качественной реакции на ион аммония:
5. Как основание аммиак реагирует с:
Исследование, описанное в статье про аммиак , подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое аммиак и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Неорганическая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Неорганическая химия
Термины: Неорганическая химия