Лекция
Привет, Вы узнаете о том , что такое 8-1. Закон Авогадро. Относительная плотность газов. Объёмная доля газа в смеси, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое 8-1. Закон Авогадро. Относительная плотность газов. Объёмная доля газа в смеси , настоятельно рекомендую прочитать все из категории Общая химия.
Как вам известно, вещества могут находиться в твердом, жидком и газообразном состоянии. Молекулы жидкости и твердого вещества располагаются близко друг к другу. Это возможно благодаря тому, что молекулы притягиваются друг к другу. То есть существуют силы, которые удерживают молекулы жидкости или твердого вещества вместе. Из курса химии 8-го класса вы знаете, что эти силы называются силами межмолекулярного взаимодействия. Молекулы газов находятся на значительно большем расстоянии друг от друга, чем в случае жидкостей и твердых веществ. На таком расстоянии молекулы практически не взаимодействуют друг с другом. Поэтому, чтобы превратить жидкость или твердое вещество в газ, необходимо преодолеть силы межмолекулярного взаимодействия, отдалив молекулы друг от друга.
Переход в газообразное состояние осуществляется в результате нагревания веществ, находящихся в твердом или жидком состоянии (кипение жидкостей, возгонка твердых веществ).
Так как расстояние между молекулами газов значительно больше размеров самих молекул, то объем, который занимает газ, — это, по существу, объем свободного пространства между хаотически движущимися молекулами газа. Величина этого пространства определяется условиями, при которых находится газ, т. е. температурой и давлением. Эта величина примерно одинакова для всех газов. При этом объемом, занимаемым самими молекулами, можно пренебречь. Отсюда следует закон Авогадро — в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.

Рис. 8-1. Амедео
Авогадро (1776—1856)
Интересно знать
Из курса химии 8-го класса вы уже знакомы с постоянной Авогадро, равной 6,02 ∙ 1023 моль–1, которая показывает, сколько частиц содержится в одном моле вещества. Эта величина названа в честь выдающегося итальянского ученого Амедео Авогадро, внесшего значительный вклад в развитие молекулярной физики, электрохимии и других областей естествознания. На основании исследования соотношения объемов реагирующих и образующихся газов, таких как водород и хлор, кислород и азот, Авогадро впервые предположил, что молекулы азота, кислорода, водорода и хлора состоят из двух атомов. Это предположение, сначала долго не находившее понимания у ученых того времени, впоследствии блестяще подтвердилось.
Из закона Авогадро вытекают два основных следствия.
Первое следствие. Один моль любого газа при одинаковых условиях занимает одинаковый объем. Этот объем называется молярным объемом газа (Vm), и измеряется в дм3/моль. Молярный объем газа равен отношению объема газа к его количеству:
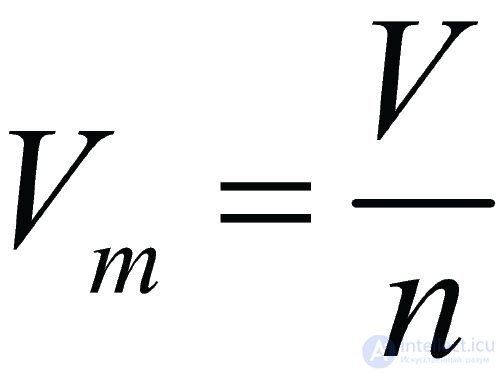 .
.
Величина Vm зависит от температуры и давления. Например, при нагревании газы расширяются. Значит, при нагревании увеличивается молярный объем газа. В связи с этим сравнение характеристик различных газовых смесей необходимо осуществлять при одинаковых условиях — температуре и давлении. В качестве эталона таких условий приняты нормальные условия (н. у.): температура таяния льда (0 °С или 273,15 K) и атмосферное давление (101,3 кПа). При нормальных условиях Vm = 22,4 дм3/моль.
Таким образом, из закона Авогадро следует, что 22,4 дм3 любого газа при нормальных условиях содержат 6,02 ∙ 1023 молекул.
Второе следствие. Плотности газов относятся между собой как молярные массы газов.
Это видно из следующих соображений. Пусть имеется две порции различных газов. Об этом говорит сайт https://intellect.icu . Рассчитаем их плотности:
газ 1: 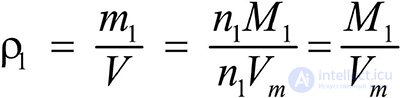 ;
;
газ 2: 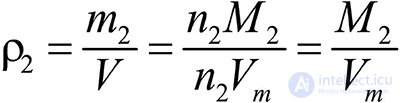 .
.
Разделив плотность первого газа на плотность второго, получим: 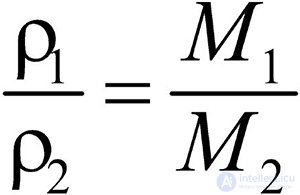 .
.
Отношение плотностей газов, равное отношению молярных масс, называется относительной плотностью одного газа по другому (D). D — величина безразмерная.
Зная D и молярную массу одного газа, легко найти молярную массу другого газа:

Пример 1. Относительная плотность газа по водороду равна 8. Определите молярную массу газа.
М(Х) = М(Н2) ∙ D = 2 ∙ 8 = 16 г/моль.
Газ с такой молярной массой — метан СH4.
Пример 2. Относительная плотность некоторого газообразного углеводорода по воздуху равна 2. Определите молярную массу углеводорода.
Средняя молярная масса воздуха равна 29 г/моль;
М(Х) = М(возд.) ∙ D = 29 ∙ 2 = 58 г/моль.
Углеводород с такой молярной массой — бутан С4Н10.
Следует отметить, что газы с молярной массой меньше 29 легче воздуха, больше 29 — тяжелее.
В расчетных задачах могут быть даны относительные плотности неизвестного газа по азоту, кислороду и другим газам. В этом случае для нахождения молярной массы неизвестного газа необходимо умножить относительную плотность на молярную массу соответственно азота (28 г/моль), кислорода (32 г/моль) и т. д.
Закон Авогадро широко применяется в химических расчетах. Поскольку для газов объемы пропорциональны количествам (моль) веществ, то коэффициенты в уравнении реакции между газообразными веществами, отражающие количественное соотношение реагирующих веществ, пропорциональны объемам взаимодействующих газов. Очевидно, что объемы должны быть измерены при одинаковых условиях.
Пример 3. Какой объем кислорода потребуется для сжигания 2 дм3 пропана? Объемы измерены при н. у.
Уравнение реакции горения пропана:
С3Н8 + 5О2  3СО2 + 4Н2О
3СО2 + 4Н2О
Из закона Авогадро следует, что равные объемы различных газов содержат одинаковое количество (моль) веществ. Пусть объем пропана равен 1 дм3. Тогда, согласно приведенному уравнению, для сжигания 1 дм3 пропана потребуется 5 дм3 кислорода. Следовательно, для сжигания 2 дм3 пропана потребуется:
1 дм3 С3Н8 — 5 дм3 O2,
2 дм3 С3Н8 — 10 дм3 О2
Ответ: V(О2) = 10 дм3.
Смеси газов
Рассмотрим две колбы объемом 0,5 дм3. Одна колба заполнена азотом, а другая метаном. Давление и температура в колбах одинаковые. Если смешать содержимое этих колб, то полученная смесь займет при таких же условиях объем 1 дм3.
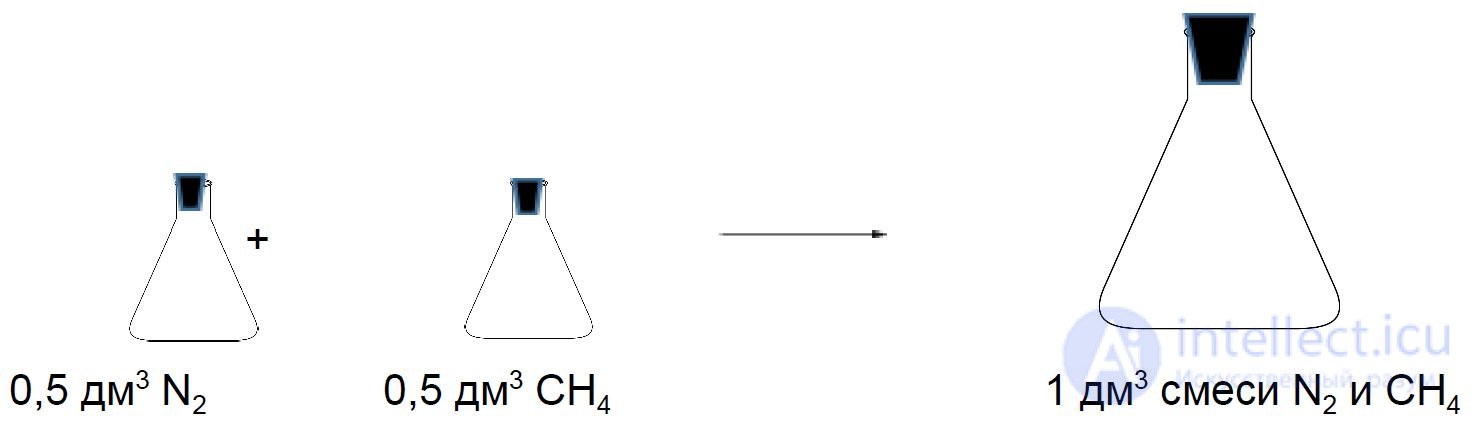
Состав смеси газов часто выражают в объемных долях. Объемная доля газа обозначается греческой буквой φ (фи) и равна отношению объема данного газа к объему смеси. Рассчитаем объемную долю азота в полученной выше смеси газов:
φ = 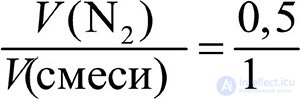 = 0,5, или 50 %.
= 0,5, или 50 %.
Пример 4. В результате пропускания 150 дм3 (н. у.) воздуха через избыток известковой воды выпало 0,201 г осадка. Найдите объемную долю (%) углекислого газа в данном образце воздуха.
Уравнение реакции взаимодействия углекислого газа с известковой водой:
СО2 + Са(ОН)2 = СаСО3 + Н2О
+ Н2О
Найдем количество (моль) карбоната кальция, выпавшего в осадок (M(CaCO3) = 100 г/моль):
n(СаСО3) = 0,201/100 = 0,00201 моль.
По уравнению реакции:
n(СаСО3) = n(СО2).
Рассчитаем объемную долю углекислого газа в воздухе:
V(CO2) = 0,00201 ∙ 22,4 = 0,045 дм3;
φ(СО2) = 0,045/150 = 0,0003, или 0,03 %.
Ответ: φ(СО2) = 0,03 %.
Пример 5. Объем смеси водорода с хлором составляет 50 см3. После взаимодействия газов осталось 10 см3 хлора. Найдите состав исходной смеси в объемных долях. Все объемы измерены при н. у.
Уравнение реакции взаимодействия водорода с хлором:
H2 + Cl2  2HCl
2HCl
Поскольку после взаимодействия осталось 10 см3 хлора, то 40 см3 исходной смеси прореагировало. Хлор и водород реагируют между собой в равных объемных отношениях. Исходя из этих соображений, в реакцию вступили по 20 см3 хлора и водорода. Поскольку осталось 10 см3 хлора, то в первоначальной смеси было 20 см3 водорода и 30 см3 хлора.
Рассчитаем объемные доли газов в исходной смеси:
φ(H2) = 20/50 = 0,4, или 40 %;
φ(Cl2) = 30/50 = 0,6, или 60 %.
Ответ: φ(H2) = 40 %; φ(Cl2) = 60 %.
Согласно закону Авогадро, в равных объемах различных газов при одинаковых условиях содержится одинаковое количество молекул.
Один моль любого газа при нормальных условиях (температура таяния льда, атмосферное давление) занимает объем
22,4 дм3. Эта величина называется молярным объемом газа (Vm).
Плотности газов, измеренные при одинаковых условиях, относятся между собой как их молярные массы. Это отношение называется относительной плотностью одного газа по другому газу.
Газы, имеющие молярную массу более 29 г/моль, тяжелее воздуха, а менее 29 г/моль — легче воздуха.
Объемная доля газа в смеси равна отношению объема данного газа к общему объему смеси.
1. Сформулируйте закон Авогадро. Почему он выполняется для газообразных веществ и не выполняется для веществ в твердом или жидком состоянии?
2. Что такое молярный объем газа? Как он изменяется с увеличением температуры и давления?
3. Как результаты экспериментов по измерению объемов газов, участвующих в реакциях взаимодействия хлора с водородом и азота с кислородом, позволили Авогадро прийти к выводу о том, что азот, кислород, хлор и водород состоят из двухатомных молекул? Учтите, что в результате взаимодействия азота с кислородом, протекающего только при чрезвычайно высокой температуре, образуется оксид азота(II).
4. Относительная плотность по водороду некоторого углеводорода равна 15. Установите молярную массу углеводорода и приведите его формулу.
5. В результате взрыва смеси, состоящей из 1 дм3 неизвестного газа и 2 дм3 кислорода (исходные вещества прореагировали полностью), образовалось 2 дм3 углекислого газа и 1 дм3 азота. Все объемы измерены при одинаковых условиях. Установите формулу неизвестного газа. (Ответ: C2N2.)
Исследование, описанное в статье про 8-1. Закон Авогадро. Относительная плотность газов. Объёмная доля газа в смеси, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое 8-1. Закон Авогадро. Относительная плотность газов. Объёмная доля газа в смеси и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Общая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Органическая химия
Термины: Органическая химия