Лекция
Привет, Вы узнаете о том , что такое 2.7. Пространственное строение молекул алканов. sp3-Гибридизация, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое 2.7. Пространственное строение молекул алканов. sp3-Гибридизация , настоятельно рекомендую прочитать все из категории Органическая химия.
В предыдущем параграфе мы рассмотрели структурные формулы некоторых алканов. Структурные формулы отражают не только состав, но и последовательность соединения атомов в молекуле. В то же время структурные формулы могут не показывать пространственного строения молекулы.
Например, структурную формулу метана часто изображают следующим образом:
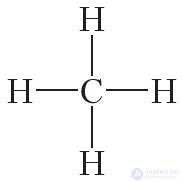
Экспериментально установлено, что молекула метана не является плоской, а имеет форму правильного тетраэдра, в центре которого находится атом углерода, а в вершинах — атомы водорода:
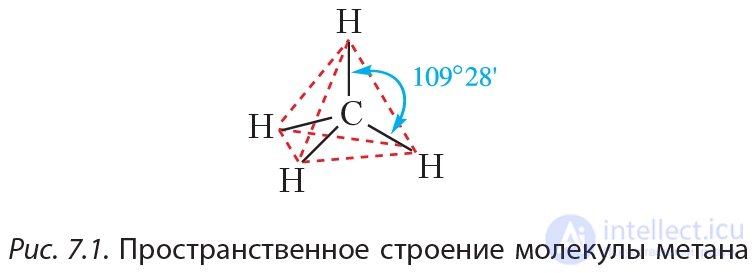
Угол между связями (валентный угол) в молекуле метана равен 109°28'. В структурной формуле метана связи часто изображают под углом 90°.
Возможны и другие варианты, например:

Все эти варианты структурных формул являются правильными, так как верно отображают последовательность соединения атомов в молекуле.
Рассмотрим строение молекулы метана более подробно. Образование связей в молекулах происходит в результате перекрывания атомных орбиталей. Строение электронной оболочки атома углерода в возбужденном состоянии показывает электронно-графическая схема:
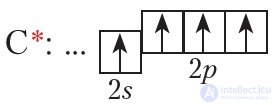
В возбужденном состоянии у атома углерода имеется один электрон на s-орбитали и три электрона на р-орбиталях. При образовании ковалентных связей с атомами водорода возможны два способа перекрывания электронных облаков (рис. 7.2 и 7.3).
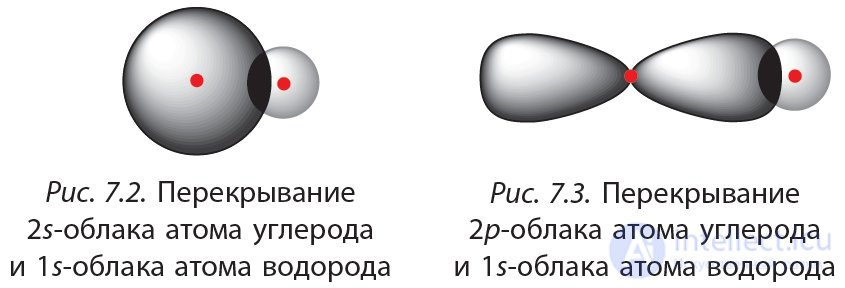 Связь, образованная в результате перекрывания 2s-орбитали атома углерода и 1s-орбитали атома водорода (рис. 7.2), должна отличаться от трех других связей, которые образуются в результате перекрывания 2p-орбиталей атома углерода и 1s-орбитали атома водорода (рис. 7.3). В действительности все четыре связи в молекуле метана совершенно одинаковы. Об этом говорит сайт https://intellect.icu . Для объяснения этого факта используются представления о гибридизации атомных орбиталей.
Связь, образованная в результате перекрывания 2s-орбитали атома углерода и 1s-орбитали атома водорода (рис. 7.2), должна отличаться от трех других связей, которые образуются в результате перекрывания 2p-орбиталей атома углерода и 1s-орбитали атома водорода (рис. 7.3). В действительности все четыре связи в молекуле метана совершенно одинаковы. Об этом говорит сайт https://intellect.icu . Для объяснения этого факта используются представления о гибридизации атомных орбиталей.
При образовании ковалентных связей в молекуле метана четыре валентные орбитали атома углерода смешиваются и образуют четыре орбитали одинаковой формы (гибридные орбитали):
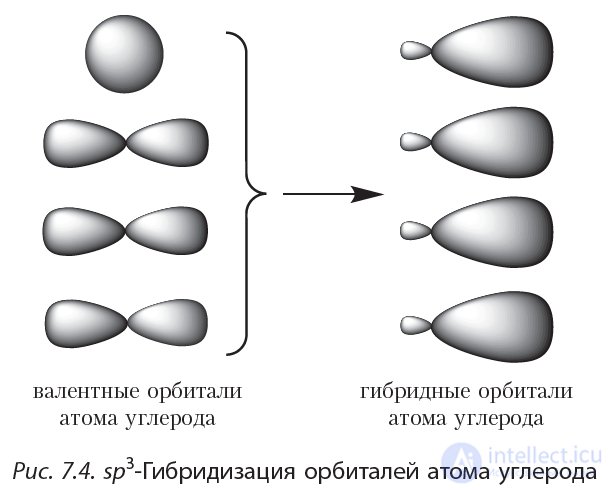 Рассмотрим, как располагаются четыре гибридные орбитали атома углерода в пространстве. Электронные облака имеют отрицательный заряд, следовательно, гибридные орбитали должны располагаться таким образом, чтобы электростатическое отталкивание одноименно заряженных электронов было наименьшим. Данному условию отвечает расположение гибридных орбиталей под углом 109°28' (рис. 7.5):
Рассмотрим, как располагаются четыре гибридные орбитали атома углерода в пространстве. Электронные облака имеют отрицательный заряд, следовательно, гибридные орбитали должны располагаться таким образом, чтобы электростатическое отталкивание одноименно заряженных электронов было наименьшим. Данному условию отвечает расположение гибридных орбиталей под углом 109°28' (рис. 7.5):
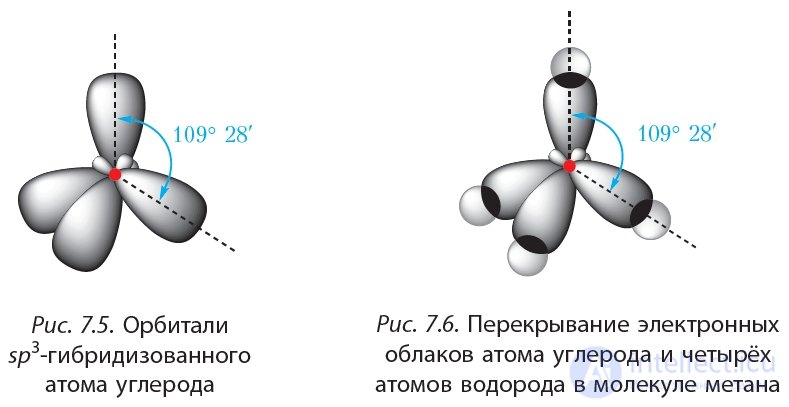
Эти выводы подтверждаются результатами исследования с помощью физико-химических методов. Действительно, молекула метана имеет тераэдрическую форму, угол между связями 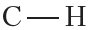 составляет 109°28' (рис. 7.6).
составляет 109°28' (рис. 7.6).
Из схемы перекрывания электронных облаков в молекуле метана видно, что гибридные электронные облака атома углерода вытянуты к атомам водорода. Такие облака могут сильнее перекрываться с электронными облаками атомов водорода и, следовательно, образовывать более прочные связи.
 В sp3-гибридизации участвуют четыре орбитали атома углерода — одна s- и три p-орбитали. sp3-Гибридные орбитали располагаются в пространстве под углом 109°28'.
В sp3-гибридизации участвуют четыре орбитали атома углерода — одна s- и три p-орбитали. sp3-Гибридные орбитали располагаются в пространстве под углом 109°28'.
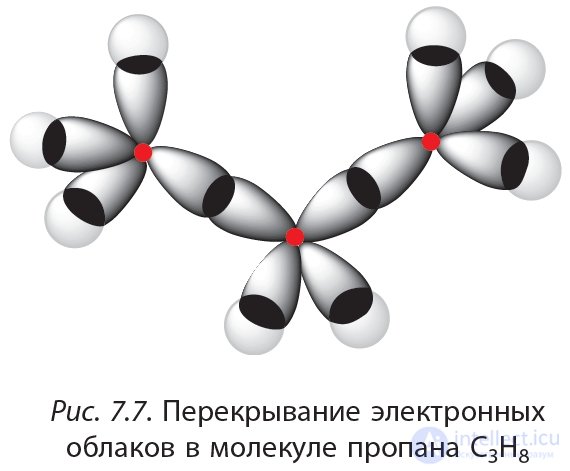
Молекулы других алканов так же, как и молекула метана, построены из sp3-гибридных атомов углерода. Каждый sp3-гибридный атом углерода образует четыре ковалентные связи. Угол между этими связями приблизительно равен 109°(рис. 7.7).
Пространственное строение молекул органических соединений можно наглядно отобразить с помощью шаростержневых моделей.
Моделями атомов углерода являются шарики серого цвета с четырьмя отверстиями; моделями атомов водорода — шарики белого цвета с одним отверстием. Модели ковалентных химических связей — пластмассовые стержни. На рисунке 7.8 показаны шаростержневые модели молекул метана, пропана и н-бутана.
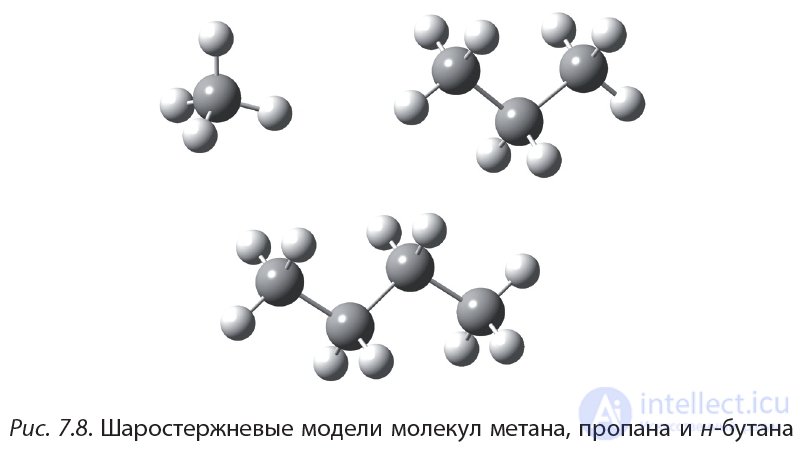
Видно, что атомы углерода в молекулах пропана и н-бутана не лежат на одной прямой. Например, углеродная цепь молекулы н-бутана имеет форму ломаной линии. Это объясняется тем, что угол между связями 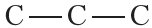 в молекулах алканов приблизительно равен 109°.
в молекулах алканов приблизительно равен 109°.
Для изображения структуры алканов и других органических веществ часто используют формулы, в которых вообще не указываются химические символы углерода и водорода. Формулы алканов в этом случае представляют собой ломаные линии, отображающие углеродный скелет молекулы. Такие формулы называются скелетными формулами. Очевидно, что скелетные формулы можно записывать для алканов, начиная с этана, при этом формула этана имеет вид черточки, а формула пропана представляет собой ломаную линию, состоящую из двух прямых, и т. д.:
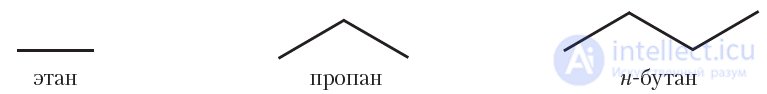
Скелетные формулы органических соединений широко используются, наряду с обычными структурными формулами. Преимущество данных формул — компактность и быстрота написания. Кроме этого, скелетные формулы, в отличие от структурных формул, дают представление о пространственном строении молекул органических соединений.
|
Молекулы алканов построены из sp3-гибридизованных атомов углерода. Каждый sp3-гибридизованный атом углерода образует четыре ковалентные связи. Угол между этими связями приблизительно равен 109о. Углеродная цепь молекул алканов имеет форму ломаной линии. |
1. Почему молекула метана не является плоской?
2. Изобразите перекрывание электронных облаков в молекуле этана. Укажите приблизительные значения валентных углов в этой молекуле.
3. Алкан, имеющий неразветвленную цепь из шести атомов углерода, называется н-гексан. Составьте структурную формулу н-гексана. Почему углеродная цепь молекулы н-гексана не является прямой линией, а имеет форму ломаной линии? Может ли углеродная цепь молекулы н-гексана принимать другие пространственные формы?
4. Укажите, сколько различных веществ обозначено следующими структурными формулами:
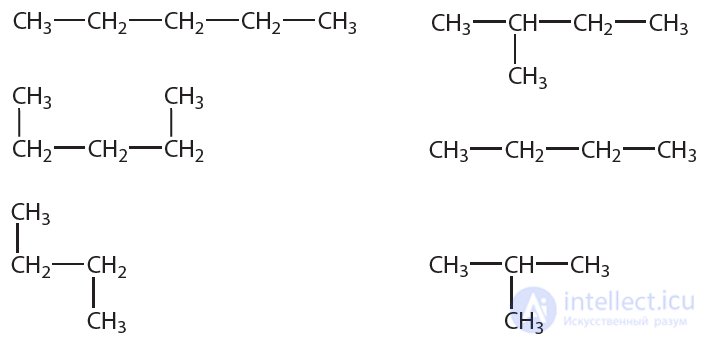
5. Найдите изомеры среди веществ, формулы которых приведены ниже:
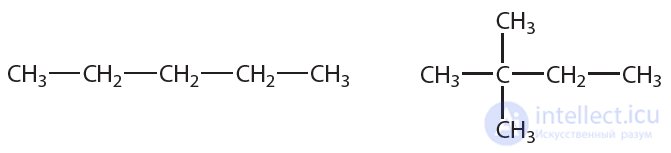
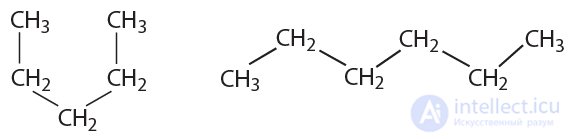
6. Чему равны значения длин связей  и валентных углов в молекулах алканов?
и валентных углов в молекулах алканов?
Исследование, описанное в статье про 2.7. Пространственное строение молекул алканов. sp3-Гибридизация, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое 2.7. Пространственное строение молекул алканов. sp3-Гибридизация и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Органическая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Органическая химия
Термины: Органическая химия