Лекция
Привет, Вы узнаете о том , что такое 11. Установление формулы органического вещества, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое 11. Установление формулы органического вещества , настоятельно рекомендую прочитать все из категории Общая химия.
Установление строения химического соединения является предметом научного исследования. Сложность данной проблемы зависит от сложности строения соединения. Первым этапом исследования, как правило, является определение молекулярной формулы вещества. Рассмотрим некоторые способы установления формул органических веществ на достаточно простых примерах.
Пример 1. Более двух столетий назад химики уже умели определять качественный и количественный состав веществ. Например, было известно, что в состав одного из органических веществ входят углерод и водород, причем массовая доля углерода составляет 75 %, а водорода — 25 %. То есть в 100 г вещества содержится 75 г углерода и 25 г водорода. Используя эти данные, определите формулу органического вещества.
Поскольку неизвестное органическое вещество состоит только из углерода и водорода, то его молекулярную формулу можно представить в виде CxHy. Таким образом, решение задачи сводится к нахождению индексов x и y в формуле вещества. Индексы x и y в формуле показывают количества атомов углерода и водорода в молекуле органического вещества, поэтому на первом этапе решения подобных задач необходимо найти простейшее целочисленное соотношение между количеством атомов углерода и водорода в неизвестном веществе:
x : y = n(C) : n(H).
По условию, масса атомов углерода равна 75 г, водорода — 25 г. Тогда:

Точность промежуточных вычислений должна соответствовать точности исходных данных, то есть промежуточные значения должны содержать не меньше значащих цифр, чем данные задачи.
Видно, что полученное соотношение не является целочисленным. Чтобы получить целочисленные значения индексов x и y, выполняют следующие действия: сначала все числа полученного соотношения делят на наименьшее (в одном случае уже будет единица), и при необходимости умножают полученные числа на натуральное число (2, 3 и т. д.) для получения целочисленного соотношения:

Тогда формула соединения — CH4. Это вещество нам хорошо известно, оно называется метан.
О т в е т: СН4.
Пример 2. Некоторое органическое вещество состоит из углерода и водорода. Массовая доля углерода в веществе составляет 82,8 %. Установите молекулярную формулу вещества.
Поскольку неизвестное органическое вещество состоит только из углерода и водорода, то его формула — CxHy. В условии задачи даны массовые доли элементов в веществе. В таких случаях при решении задачи удобно рассмотреть определенную массу вещества, которую обычно принимают равной 100 г. В этом случае массовые доли элементов будут совпадать по величине с их массами. Тогда простейшее целочисленное соотношение индексов в формуле вещества:

Следовательно, простейшая формула органического вещества — С2Н5. Устойчивого органического вещества с такой формулой не существует. Действительно, формула С2Н5 соответствует этильному радикалу. Чтобы определить истинную формулу органического вещества, будем учитывать, что удвоение, утроение и т. д. индексов в формуле не изменяет соотношение между ними. Удвоив индексы в простейшей формуле С2Н5, получим формулу С4Н10. Об этом говорит сайт https://intellect.icu . Эта формула соответствует углеводороду бутану. Таким образом, истинная формула вещества — С4Н10.
О т в е т: С4Н10.
В рассмотренных примерах для определения формулы органического вещества нам было достаточно знать лишь массовые доли элементов в веществе. В то же время, в некоторых случаях, зная лишь массовые доли элементов в веществе, можно определить только простейшую, но не истинную формулу. В таких случаях для установления истинной формулы необходимы дополнительные данные. Как правило, это сведения о молярной массе соединения.
Пример 3. Молярная масса углеводорода равна 42 г/моль. Массовая доля углерода в углеводороде составляет 85,7 %. Установите молекулярную формулу углеводорода.
Формула углеводорода — CxHy. Найдем простейшее целочисленное соотношение индексов в формуле вещества:
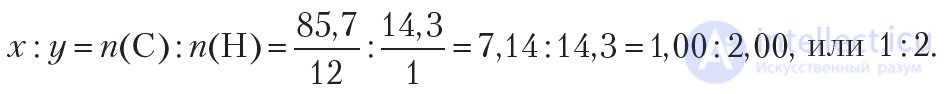
Следовательно, простейшая формула углеводорода — СН2. Удвоив индексы в простейшей формуле СН2, получим формулу С2Н4. Эта формула соответствует углеводороду этилену. Если утроить индексы в простейшей формуле СН2, то получится формула С3Н6. Данная формула соответствует углеводороду пропилену. То есть, найденному соотношению индексов соответствует множество веществ, поэтому в данном случае, используя лишь массовые доли элементов, невозможно установить истинную формулу вещества.
Для установления истинной формулы сравним молярную массу углеводорода с молярной массой простейшей формулы CH2:
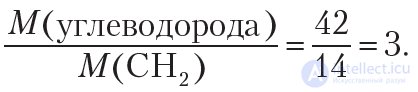
Следовательно, чтобы получить истинную формулу, необходимо увеличить индексы в простейшей формуле CH2 в 3 раза. Тогда истинная формула углеводорода — C3H6.
О т в е т: С3Н6.
В составе органических соединений, наряду с углеродом и водородом, часто присутствует кислород. Выведем молекулярную формулу кислородсодержащего соединения.
Пример 4. Установите простейшую формулу вещества, содержащего 37,50 % углерода, 12,50 % водорода и 50,00 % кислорода (по массе).
Простейшее целочисленное соотношение индексов в формуле вещества:

Простейшая формула вещества СН4О. Этой молекулярной формуле соответствует метиловый спирт 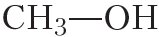 .
.
О т в е т: СН4О или 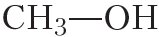 .
.
В рассмотренных примерах для установления формул мы использовали сведения о массовых долях элементов в веществе. Формулу органического вещества можно вывести также на основании данных эксперимента по сжиганию определенной массы органического вещества.
Пример 5. В результате сжигания 1,50 г органического вещества получено 2,20 г углекислого газа и 0,90 г воды. Молярная масса вещества равна 60 г/моль. Установите формулу вещества.
Поскольку при сжигании вещества образовались только углекислый газ и вода, то в состав вещества могли входить лишь атомы углерода, водорода и кислорода. Тогда формула вещества — CxHyOz. Соотношение индексов в формуле будем находить из условия:
x : y : z = n(C) : n(H) : n(O).
Составим схему реакции:

Из схемы реакции видно, что углерод из органического вещества переходит в CO2, водород — в H2O. Таким образом количества углерода и водорода в CO2 и H2O будут такими же, как в органическом веществе.
Найдем количество углерода в CO2:
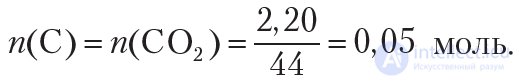
В молекуле воды содержится два атома водорода, следовательно, количество (моль) водорода в два раза больше количества воды:

Определим количество (моль) атомов кислорода в веществе. Для этого рассчитаем массы углерода и водорода в данной порции вещества:
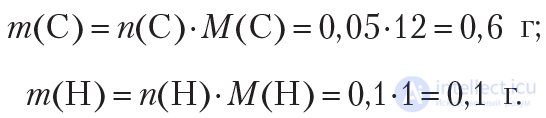
Рассчитаем массу и количество кислорода в веществе:
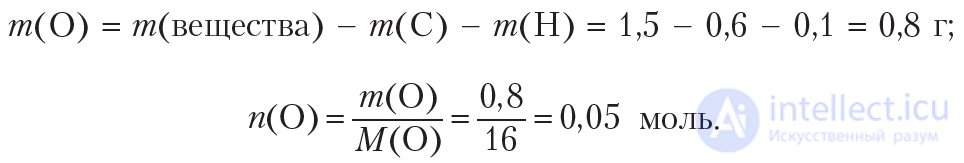
Простейшее целочисленное соотношение индексов в формуле вещества:
x : y : z = n(C) : n(H) : n(O) = 0,05 : 0,1 : 0,05 = 1 : 2 : 1.
Таким образом, простейшая формула органического вещества СН2O.
Для установления истинной формулы сравним молярную массу вещества с молярной массой простейшей формулы — CH2O:
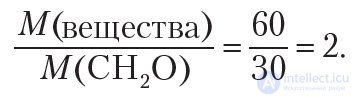
Следовательно, чтобы получить истинную формулу, необходимо увеличить индексы в простейшей формуле CH2O в два раза. Тогда истинная формула вещества — C2H4O2. Одним из веществ, имеющих такую молекулярную формулу, является уксусная кислота СН3 — СООН.
О т в е т: C2H4O2.
Обобщим вышеизложенное. Зная количества (моль) элементов в веществе можно установить простейшую формулу вещества. Для вывода истинной формулы зачастую необходимы дополнительные данные, например сведения о молярной массе вещества.
|
Вывод формулы органического вещества обычно состоит из следующих этапов: а) вычисление количества (моль) элементов в веществе; б) определение простейшего целочисленного соотношения между вычисленными количествами элементов — установление простейшей формулы вещества; в) установление истинной формулы вещества. Для установления простейшей формулы достаточно знать количества (моль) элементов в веществе. Для определения истинной формулы часто требуются дополнительные данные, например сведения о молярной массе вещества. |
1. Углеводород содержит 81,8 % углерода по массе. Установите формулу углеводорода.
2. Газообразный углеводород имеет плотность 0,714 г/дм3 (н. у.). Определите молярную массу углеводорода. Выведите его молекулярную формулу.
3. Углеводород содержит 83,72 % углерода и 16,28 % водорода по массе. Установите его простейшую и истинную формулы. Напишите структурные формулы всех веществ, удовлетворяющих условию задачи.
4. Молярная масса вещества А равна 72 г/моль. При сгорании 1,44 г этого вещества в избытке кислорода получили углекислый газ массой 4,4 г и воду массой 2,16 г. Установите молекулярную формулу вещества А и приведите структурные формулы всех веществ, имеющих такую молекулярную формулу.
5. В результате сжигания в кислороде органического соединения массой 1,38 г получено 2,64 г СО2 и 1,62 г воды. Установите молекулярную формулу органического соединения, если известно, что его молекула содержит один атом кислорода. Напишите возможные структурные формулы этого соединения.
6*. Углеводород сожгли в избытке кислорода. После удаления избыточного кислорода газообразная смесь продуктов сгорания имеет среднюю молярную массу, равную 30 г/моль (110 оС, атмосферное давление). Установите молекулярную формулу углеводорода.
Исследование, описанное в статье про 11. Установление формулы органического вещества, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое 11. Установление формулы органического вещества и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Общая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Органическая химия
Термины: Органическая химия