Лекция
Привет, Вы узнаете о том , что такое химическая связь, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое химическая связь , настоятельно рекомендую прочитать все из категории Общая химия.
Например, простое вещество водород состоит из молекул Н2, в которых два атома водорода связаны одной ковалентной связью:  .
.
| химическая связь — взаимодействие, связывающее отдельные атомы в химические соединения (молекулы или кристаллы). |
Химическая связь — это объединение атомов или ионов для образования молекул , кристаллов и других структур. Связь может быть результатом электростатической силы между противоположно заряженными ионами, как в ионных связях , или посредством совместного использования электронов, как в ковалентных связях , или некоторой комбинации этих эффектов. Химические связи описываются как имеющие различную прочность: существуют «сильные связи» или «первичные связи», такие как ковалентные , ионные и металлические связи, и «слабые связи» или «вторичные связи», такие как диполь-дипольные взаимодействия , сила дисперсии Лондона и водородные связи .
Поскольку противоположные электрические заряды притягиваются, отрицательно заряженные электроны, окружающие ядро, и положительно заряженные протоны внутри ядра притягиваются друг к другу. Электроны, общие для двух ядер, будут притягиваться к обоим ядрам. «Конструктивная квантово-механическая интерференция волновой функции »] стабилизирует спаренные ядра (см. Теории химической связи ). Связанные ядра поддерживают оптимальное расстояние (расстояние связи), уравновешивая притягивающие и отталкивающие эффекты, количественно объясняемые квантовой теорией .
Атомы в молекулах , кристаллах , металлах и других формах материи удерживаются вместе химическими связями, которые определяют структуру и свойства материи.
Все связи могут быть описаны квантовой теорией , но на практике упрощенные правила и другие теории позволяют химикам предсказывать прочность, направленность и полярность связей. Правило октета и теория VSEPR являются примерами. Более сложными теориями являются теория валентных связей , которая включает орбитальную гибридизацию и резонанс , и теория молекулярных орбиталей , которая включает линейную комбинацию атомных орбиталей и теорию поля лигандов . Электростатика используется для описания полярностей связей и их влияния на химические вещества.
Участвовать в образовании химических связей могут только те электроны, которые слабее всего связаны с ядром, то есть электроны внешнего энергетического уровня. Такие электроны называются валентными.
Валентные электроны принято обозначать точками, которые окружают символ химического элемента. Такие формулы называются электронными формулами.
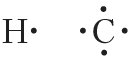
электронные формулы атомов водорода и углерода

Окружность вокруг электронной формулы указывает на завершенность внешнего слоя. То есть атом гелия имеет завершенную двухэлектронную, а атом неона — восьмиэлектронную внешнюю оболочку. Отсюда следует важный вывод — атомы будут стремиться сформировать стабильные завершенные электронные оболочки за счет отдачи, присоединения либо обобществления электронов. При этом образуются химические связи.
Пример 1. Образование ионной связи между литием и фтором.
На внешнем электронном слое атома лития находится один электрон, поэтому атом лития легко отдает этот электрон, приобретая завершенную электронную оболочку, как у ближайшего благородного газа — гелия. На внешнем слое атома фтора располагается семь электронов, поэтому фтор, наоборот, легко присоединяет один электрон, приобретая завершенную восьмиэлектронную внешнюю оболочку, как у атома неона:

При образовании фторида лития электрон от атома лития переходит к атому фтора. В результате образуются ионы Li+ и F–. Электронные конфигурации ионов Li+ и F– такие же, как у атомов гелия и неона соответственно:
Li+: 1s2
F–: …2s23p6
Разноименно заряженные ионы притягиваются друг к другу. Такая связь называется ионной. Ионная связь образуется между атомами металла и неметалла. Ионная связь имеется в солях (NaCl, KF), оксидах металлов (Na2O, K2O), гидроксидах металлов (NaOH, KOH).
Пример 2. Образование ковалентной связи в молекуле водорода H2.
На внешнем слое атома водорода имеется один неспаренный электрон. Об этом говорит сайт https://intellect.icu . Поскольку при образовании молекулы водорода между собой взаимодействуют одинаковые атомы, электрон не будет переходить от одного атома к другому и разноименно заряженные ионы образовываться не будут. Вместо этого неспаренные электроны двух атомов водорода образуют общую электронную пару. При этом каждый атом водорода приобретает завершенную электронную оболочку, как у атома гелия:

Связь, образованную посредством общих электронных пар, называют ковалентной. В формулах ковалентную связь (общую электронную пару) обозначают черточкой. Например, формулу молекулы водорода можно записать  . Такая формула называется структурной. Она показывает не только состав, но и строение молекулы.
. Такая формула называется структурной. Она показывает не только состав, но и строение молекулы.
Ковалентная связь образуется между атомами неметаллов. Ковалентная связь имеется в простых веществах неметаллов (H2, Cl2, O2, N2), оксидах неметаллов (CO2, SO2), кислотах (HCl, H2SO4).
Мы рассмотрели два типа химической связи — ковалентную и ионную. Ковалентная связь образуется между атомами неметаллов. Посредством ионной связи соединяются металлы с неметаллами.
При взаимодействии атомов металлов друг с другом возникает третий тип химической связи — металлическая связь. Подробно с этим типом связи вы знакомились в курсе химии 9-го класса. Напомним, что металлическая связь имеется в простых веществах, образованных металлами, например Na, K, Fe, и в металлических сплавах.
|
Существует три типа химической связи: ковалентная, ионная и металлическая. Ковалентная связь образуется между атомами неметаллов в простых веществах (H2, F2, O2), оксидах неметаллов (H2O, CO2), кислотах (HF, HCl, H2SO4, HNO3). Ионная связь образуется между атомами металла и неметалла в солях (NaCl, KF), оксидах металлов (K2O, BaO), гидроксидах металлов (NaOH, KOH). Металлическая связь образуется между атомами металлов в простых веществах (Na, K, Cu) и металлических сплавах. |

Как уже говорилось - химическая связь — это притяжение между атомами. Это притяжение можно рассматривать как результат различного поведения внешних или валентных электронов атомов. Эти поведения плавно переходят друг в друга при различных обстоятельствах, так что между ними невозможно провести четкую границу. Однако остается полезным и общепринятым различать различные типы связи, которые приводят к различным свойствам конденсированного вещества .
В простейшем представлении о ковалентной связи один или несколько электронов (часто пара электронов) втягиваются в пространство между двумя атомными ядрами. Энергия высвобождается при образовании связи. Это происходит не в результате уменьшения потенциальной энергии, поскольку притяжение двух электронов к двум протонам компенсируется отталкиванием электрон-электрон и протон-протон. Вместо этого высвобождение энергии (и, следовательно, стабильность связи) возникает из-за уменьшения кинетической энергии из-за того, что электроны находятся на более пространственно распределенной (т. е. с большей длиной волны де Бройля ) орбитали по сравнению с тем, когда каждый электрон ограничен ближе к своему соответствующему ядру. Эти связи существуют между двумя конкретными идентифицируемыми атомами и имеют направление в пространстве, что позволяет изображать их в виде отдельных соединительных линий между атомами на рисунках или моделировать в виде палочек между сферами в моделях.
В полярной ковалентной связи один или несколько электронов неравномерно распределены между двумя ядрами. Ковалентные связи часто приводят к образованию небольших скоплений более связанных атомов, называемых молекулами , которые в твердых телах и жидкостях связаны с другими молекулами силами, которые часто намного слабее ковалентных связей, удерживающих молекулы вместе внутри. Такие слабые межмолекулярные связи придают органическим молекулярным веществам, таким как воски и масла, их мягкий объемный характер и их низкие температуры плавления (в жидкостях молекулы должны прекратить большинство структурированных или ориентированных контактов друг с другом). Однако, когда ковалентные связи связывают длинные цепи атомов в больших молекулах (как в полимерах, таких как нейлон ), или когда ковалентные связи распространяются в сетях через твердые тела, которые не состоят из дискретных молекул (таких как алмаз или кварц или силикатные минералы во многих типах горных пород), то структуры, которые получаются, могут быть как прочными, так и жесткими, по крайней мере, в направлении, правильно ориентированном сетками ковалентных связей. Кроме того, температуры плавления таких ковалентных полимеров и сетей значительно увеличиваются.
В упрощенном представлении об ионной связи связывающий электрон вообще не делится, а переносится. В этом типе связи внешняя атомная орбиталь одного атома имеет вакансию, которая позволяет добавить один или несколько электронов. Эти вновь добавленные электроны потенциально занимают более низкое энергетическое состояние (фактически ближе к большему ядерному заряду), чем они испытывают в другом атоме. Таким образом, одно ядро предлагает более прочно связанное положение для электрона, чем другое ядро, в результате чего один атом может передать электрон другому. Этот перенос заставляет один атом принимать чистый положительный заряд, а другой — чистый отрицательный заряд. Затем связь возникает из-за электростатического притяжения между положительно и отрицательно заряженными ионами . Ионные связи можно рассматривать как крайние примеры поляризации в ковалентных связях. Часто такие связи не имеют определенной ориентации в пространстве, поскольку они возникают из-за равного электростатического притяжения каждого иона ко всем ионам вокруг них. Ионные связи прочны (и поэтому ионные вещества требуют высоких температур для плавления), но также хрупки, поскольку силы между ионами имеют короткий радиус действия и не могут легко перекрывать трещины и изломы. Этот тип связи обусловливает физические характеристики кристаллов классических минеральных солей, таких как поваренная соль.
Менее часто упоминаемый тип связи — металлическая связь . В этом типе связи каждый атом в металле отдает один или несколько электронов «морю» электронов, которые находятся между многими атомами металла. В этом море каждый электрон свободен (в силу своей волновой природы ) быть связанным с большим количеством атомов одновременно. Связь возникает из-за того, что атомы металла становятся несколько положительно заряженными из-за потери своих электронов, в то время как электроны остаются притянутыми ко многим атомам, не являясь частью какого-либо данного атома. Металлическую связь можно рассматривать как крайний пример делокализации электронов по большой системе ковалентных связей, в которой участвует каждый атом. Этот тип связи часто очень прочен (что приводит к прочности металлов на разрыв). Однако металлическая связь более коллективна по своей природе, чем другие типы, и поэтому она позволяет кристаллам металлов легче деформироваться, поскольку они состоят из атомов, притянутых друг к другу, но не каким-либо определенным образом. Это приводит к пластичности металлов. Облако электронов в металлических связях обуславливает характерную для металлов хорошую электро- и теплопроводность, а также их блестящий блеск , отражающий большинство частот белого света.
Поскольку атомы и молекулы трехмерны, трудно использовать единый метод для обозначения орбиталей и связей. В молекулярных формулах химические связи (связывающие орбитали) между атомами обозначаются по-разному в зависимости от типа обсуждения. Иногда некоторые детали игнорируются. Например, в органической химии иногда рассматривается только функциональная группа молекулы. Таким образом, молекулярная формула этанола может быть записана в конформационной форме, трехмерной форме, полной двумерной форме (указывая каждую связь без трехмерных направлений), сжатой двумерной форме (CH 3 –CH 2 –OH), путем отделения функциональной группы от другой части молекулы (C 2 H 5 OH) или ее атомными составляющими (C 2 H 6 O), в зависимости от того, что обсуждается. Иногда даже обозначаются несвязывающие электроны валентной оболочки (с двумерными приблизительными направлениями), например, для элементарного углерода . ' C ' . Некоторые химики также могут отмечать соответствующие орбитали, например, гипотетический анион этилена −4 ( \ / C=C / \ −4 ), указывающий на возможность образования связи.
Существует несколько типов слабых связей, которые могут быть образованы между двумя или более молекулами, которые не связаны ковалентно. Межмолекулярные силы заставляют молекулы притягиваться или отталкиваться друг от друга. Часто эти силы влияют на физические характеристики (например, температуру плавления ) вещества.
Силы Ван-дер-Ваальса — это взаимодействия между молекулами с закрытыми оболочками . Они включают в себя как кулоновские взаимодействия между частичными зарядами в полярных молекулах, так и отталкивания Паули между закрытыми электронными оболочками.
Силы Киезома — это силы между постоянными диполями двух полярных молекул. Силы дисперсии Лондона — это силы между индуцированными диполями разных молекул. Также может быть взаимодействие между постоянным диполем в одной молекуле и индуцированным диполем в другой молекуле
Водородные связи вида A--H•••B возникают, когда A и B являются двумя высоко электроотрицательными атомами (обычно N, O или F), так что A образует высокополярную ковалентную связь с H, так что H имеет частичный положительный заряд, а B имеет неподеленную пару электронов, которая притягивается к этому частично положительному заряду и образует водородную связь. Водородные связи ответственны за высокие температуры кипения воды и аммиака по сравнению с их более тяжелыми аналогами. В некоторых случаях похожая галогенная связь может быть образована атомом галогена, расположенным между двумя электроотрицательными атомами в разных молекулах.
На коротких расстояниях силы отталкивания между атомами также становятся важными.
В (нереальном) пределе «чистой» ионной связи электроны идеально локализованы на одном из двух атомов в связи. Такие связи могут быть поняты классической физикой . Сила между атомами зависит от изотропных континуальных электростатических потенциалов. Величина силы находится в простой пропорции к произведению двух ионных зарядов согласно закону Кулона
Ковалентные связи лучше понимаются с помощью теории валентных связей (ВС) или теории молекулярных орбиталей (МО) . Свойства вовлеченных атомов можно понять с помощью таких понятий, как степень окисления , формальный заряд и электроотрицательность . Электронная плотность внутри связи не приписывается отдельным атомам, а вместо этого делокализована между атомами. В теории валентных связей связь концептуализируется как построенная из электронных пар, которые локализованы и совместно используются двумя атомами посредством перекрытия атомных орбиталей. Концепции гибридизации орбиталей и резонанса дополняют это базовое понятие связи электронной пары. В теории молекулярных орбиталей связь рассматривается как делокализованная и распределенная по орбиталям, которые простираются по всей молекуле и адаптированы к ее свойствам симметрии, как правило, путем рассмотрения линейных комбинаций атомных орбиталей (ЛКАО). Теория валентных связей более химически интуитивно понятна, поскольку она пространственно локализована, что позволяет сосредоточить внимание на частях молекулы, претерпевающих химические изменения. Напротив, молекулярные орбитали более «естественны» с точки зрения квантовой механики, при этом орбитальные энергии физически значимы и напрямую связаны с экспериментальными энергиями ионизации из фотоэлектронной спектроскопии . Следовательно, теория валентных связей и теория молекулярных орбиталей часто рассматриваются как конкурирующие, но взаимодополняющие структуры, которые предлагают различные взгляды на химические системы. Как подходы к теории электронной структуры, методы МО и ВС могут давать приближения к любому желаемому уровню точности, по крайней мере, в принципе. Однако на более низких уровнях приближения различаются, и один подход может лучше подходить для вычислений, включающих конкретную систему или свойство, чем другой.
В отличие от сферически симметричных кулоновских сил в чистых ионных связях, ковалентные связи, как правило, направлены и анизотропны . Они часто классифицируются на основе их симметрии относительно молекулярной плоскости как сигма-связи и пи-связи . В общем случае атомы образуют связи, которые являются промежуточными между ионными и ковалентными, в зависимости от относительной электроотрицательности вовлеченных атомов. Связи этого типа известны как полярные ковалентные связи
1. Почему атомы большинства химических элементов не существуют при обычных условиях в свободном виде (в виде несвязанных между собой атомов)? Имеются ли исключения из этой закономерности?
2. Что такое валентные электроны? Укажите число валентных электронов в атомах водорода, углерода, азота.
3. При помощи электронных формул изобразите образование ковалентных связей в молекулах F2 и N2. Электронную оболочку какого благородного газа приобретают атомы, образовавшие химическую связь в данных молекулах?
4. Определите тип химической связи в веществах: I2, H2O, KCl, Na2S, CO2, O2, CH4, Cu.
Исследование, описанное в статье про химическая связь, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое химическая связь и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Общая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Органическая химия
Термины: Органическая химия