Лекция
Привет, Вы узнаете о том , что такое 1.5. Предмет органической химии. Теория строения органических веществ, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое 1.5. Предмет органической химии. Теория строения органических веществ , настоятельно рекомендую прочитать все из категории Общая химия.
Изучая неорганическую химию, вы познакомились с веществами самого разнообразного состава, многие из которых являются основой минералов, строительных материалов, минеральных удобрений, драгоценных камней и т. д. При этом вы не встречали, чтобы какой-нибудь один химический элемент непременно присутствовал во всех неорганических веществах. Отличительной особенностью органических веществ является то, что в их состав наряду с другими элементами всегда входят атомы углерода. Изучение соединений углерода — их строения, химических свойств, способов получения — и составляет предмет органической химии.
| Органическая химия — химия соединений углерода. |
Наряду с углеродом в состав органических веществ чаще всего входят водород (CH4 — метан), кислород (СH3COOH — уксусная кислота) и азот (C6H5NH2 — анилин), реже — галогены (CCl4 — тетрахлорметан), сера (CH3SH — метилмеркаптан) и другие элементы. Отметим, что некоторые соединения углерода относятся к неорганическим веществам. Вы познакомились с ними ранее. Это углекислый газ (СО2), угольная кислота (Н2СО3), ее соли — карбонаты и некоторые другие вещества.
Число известных органических соединений значительно превышает число неорганических соединений. Такое многообразие обусловлено способностью атомов углерода соединяться друг с другом с образованием цепей и циклов, включающих сотни и даже тысячи атомов углерода.
Следует отметить, что органические вещества известны человечеству с древних времен. Применяя сравнительно простые способы переработки растений, люди издавна умели получать тростниковый сахар, природные красители, растительные масла, уксус и т. д. Однако наука о соединениях углерода возникла лишь в начале XIX века, после того как химики научились определять состав веществ и выражать его в виде молекулярных формул. Тогда стало известно, что вещества растительного и животного происхождения содержат углерод.
В 1806 году шведский химик Я. Берцелиус предложил называть вещества, получаемые из живых организмов, органическими, а науку, изучающую их, — органической химией. Наличие углерода в каждом органическом веществе позволило Берцелиусу определить органическую химию как химию соединений углерода. Такое определение является общепринятым и в настоящее время. Вместе с тем Берцелиус ошибочно считал, что принципиальным отличием органических веществ от неорганических является то, что первые не могут быть получены в лаборатории, а создаются только живыми организмами под влиянием особой «жизненной силы». Теория «жизненной силы» получила название «витализм» (от лат. vitalis — жизненный). Этой теории вскоре был нанесен сокрушительный удар, когда в 1824 году из неорганических веществ немецким химиком Ф. Велером была синтезирована щавелевая кислота, а в 1828 году — мочевина. В 1845 году была получена уксусная кислота (А. Кольбе, Германия), а в 1854 году французский химик М. Бертло синтетическим путем получил жиры. В настоящее время синтезированы многие органические вещества, не только имеющиеся в природе, но и не встречающиеся в ней, например лекарственные препараты, пластмассы, синтетические каучуки, жидкие кристаллы и многие другие. Таким образом, учение о «жизненной силе» потерпело полное поражение. Тем не менее, разделение химии на органическую (химию соединений углерода) и неорганическую сохранилось и по сей день.
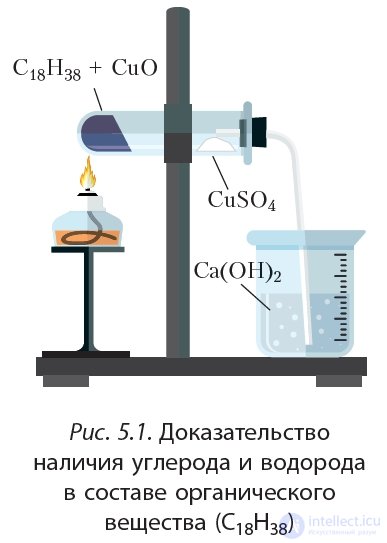 В состав всех органических веществ входит углерод. Об этом говорит сайт https://intellect.icu . Большинство органических соединений содержит также атомы водорода. Доказательством того, что в состав органических соединений входят углерод и водород, является следующий опыт.
В состав всех органических веществ входит углерод. Об этом говорит сайт https://intellect.icu . Большинство органических соединений содержит также атомы водорода. Доказательством того, что в состав органических соединений входят углерод и водород, является следующий опыт.
В пробирку помещают оксид меди(II) и парафин. Парафин представляет собой смесь твердых углеводородов (органических веществ, состоящих из углерода и водорода). Пробирку закрепляют горизонтально в лабораторном штативе (рис. 5.1). На стенку пробирки ближе к горлышку осторожно помещают безводный сульфат меди(II).
Безводный сульфат меди(II) CuSO4 имеет белый цвет, в отличие от голубого медного купороса CuSO4 · 5H2O. Закрывают пробирку пробкой с газоотводной трубкой, конец трубки помещают в стаканчик с прозрачной известковой водой (водный раствор гидроксида кальция Ca(OH)2). Пробирку нагревают в пламени спиртовки.
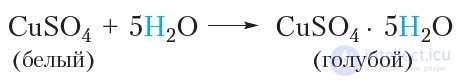
Оксид меди(II) в данном опыте выступает в роли окислителя. Он окисляет углеводороды до СО2 и воды, при этом оксид меди(II) восстанавливается до меди. Например для углеводорода C18H38, входящего в состав парафина, протекающую реакцию можно отразить уравнением:
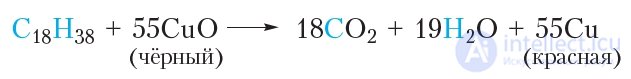
В ходе эксперимента наблюдаются следующие явления. На стенках пробирки появляются капельки воды, при этом белый сульфат меди(II) приобретает голубой цвет, так как превращается в медный купорос:
Выделяющийся углекислый газ вызывает помутнение известковой воды, так как образуется белый осадок CaCO3:

Остаток реакционной смеси приобретает красный оттенок из-за образования металлической меди. Таким образом, этот опыт доказывает наличие углерода и водорода в молекулах органического вещества.
Теория строения органических веществ сформировалась во второй половине XIX века. К этому времени были получены и исследованы многие органические соединения, установлен их качественный и количественный состав, описаны свойства.
Так, в конце XVIII — начале XIX века были выделены важнейшие углеводороды (органические вещества, состоящие только из углерода и водорода) и установлены их молекулярные формулы. Однако оказалось, что знания молекулярных формул, отражающих только состав вещества, явно недостаточно для понимания строения и свойств органических соединений. Приведем примеры некоторых противоречий, заводивших в тупик ученых первой половины XIX века.
Пример 1. Молекулярные формулы простейших углеводородов метана, этана и пропана — CH4, C2H6 и C3H8 соответственно.
К середине XIX века Э. Франкландом уже было предложено понятие валентности атомов, а А. Кекуле предположил, что атомы углерода четырехвалентны. Если исходить из того, что водород одновалентен, то, рассматривая приведенные молекулярные формулы, можно ошибочно предположить, что только в метане CH4 углерод имеет валентность, равную четырем, валентность углерода в этане C2H6 должна равняться трем, а в пропане C3H8 углерод должен иметь дробную валентность.
 Пример 2. Одинаковую формулу C4H10 имеют два различных вещества.
Пример 2. Одинаковую формулу C4H10 имеют два различных вещества.
Температура кипения одного из этих веществ равна –0,5 °С, тогда как температура кипения второго более чем на 11 °С ниже и составляет –12 °С. Накопление подобных необъяснимых на тот момент фактов стало предпосылкой создания новой теории — теории строения органических соединений. Ее основные положения в середине XIX века сформулировал А. М. Бутлеров.
К тому времени было известно, что молекулы состоят из атомов, но ученые еще не придавали значения тому, как атомы располагаются в молекуле, и считали, что познать это невозможно. А. М. Бутлеров высказал предположение о том, что атомы в молекуле соединены в определенной последовательности, которую можно установить химическими методами и отразить в структурной формуле.
Сформулируем важнейшие положения теории строения органических соединений А. М. Бутлерова:
Данная теория открыла путь к широкому распространению структурных формул для отображения строения органических веществ.
Используем положения теории А. М. Бутлерова для объяснения противоречий, описанных в примерах 1 и 2.
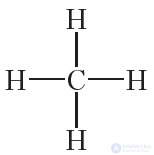
Сначала объясним строение молекул простейших углеводородов. Учитывая, что валентность углерода равна четырем, а валентность водорода — единице, структурная формула метана CH4 следующая:
В молекуле этана C2H6 все атомы углерода и водорода входят в состав одной частицы. Для этого два атома углерода должны образовать друг с другом химическую связь. Оставшиеся три единицы валентности каждый атом углерода использует для соединения с тремя атомами водорода. Тогда структурная формула этана:

Аналогичные рассуждения для пропана C3H8 приводят к структурной формуле:
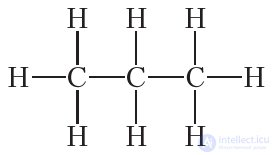
Как видно, во всех этих углеводородах углерод четырехвалентен. Рассмотрим теперь, какое влияние на свойства веществ оказывает последовательность связывания атомов в молекуле на примере соединения с молекулярной формулой C4H10. Можно составить две цепи из четырех атомов углерода: линейную и разветвленную:

Таким образом, молекулярную формулу C4H10 имеют два вещества:

Так как н-бутан (н — сокращенное от нормальный) и изобутан являются разными веществами, они должны иметь различные свойства. Действительно, температура кипения н-бутана равна –0,5 °С, тогда как температура кипения изобутана равна –12 °С. Таким образом, теория Бутлерова позволила объяснить, почему соединения, имеющие совершенно одинаковый состав, могут обладать различными свойствами. Вещества, молекулы которых имеют одинаковый качественный и количественный состав, но разное строение, называются изомерами.
Дальнейшее развитие науки только дополняло и совершенствовало теорию А. М. Бутлерова, показало ее справедливость не только для органических, но и для неорганических соединений. Структурные формулы, впервые предложенные А. М. Бутлеровым, и сегодня с успехом используются для отображения строения молекул как органических, так и неорганических соединений.
Значение теории состоит в систематизации огромного фактического материала, что дало возможность целенаправленного синтеза новых веществ с заданными свойствами.
|
Органическая химия — химия соединений углерода. Органические соединения являются основой живых организмов. В основе теории строения органических соединений А. М. Бутлерова лежат представления о том, что свойства веществ определяются не только их составом, но и последовательностью соединения атомов в молекуле. Молекулы различных веществ могут иметь одинаковый состав, но разную последовательность соединения атомов в молекуле. |
1. Атомы какого элемента входят в состав всех органических веществ?
2. В чем сущность теории «жизненной силы»? Назовите ученых, внесших значительный вклад в развитие органической химии.
3. Как можно доказать наличие атомов углерода и водорода в составе молекул органических соединений?
4. Сформулируйте важнейшие положения теории строения органических веществ. Справедлива ли эта теория для неорганических соединений?
5. Перечислите основные принципы строения молекул органических соединений. Чему равна валентность атомов углерода в составе органических веществ?
6. Какой тип химической связи преобладает в молекулах органических соединений?
7. При пропускании газообразных продуктов полного окисления органического вещества массой 0,508 г через избыток известковой воды было получено 3,600 г осадка. Вычислите массовую долю (%) углерода в органическом веществе.
Исследование, описанное в статье про 1.5. Предмет органической химии. Теория строения органических веществ, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое 1.5. Предмет органической химии. Теория строения органических веществ и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Общая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Органическая химия
Термины: Органическая химия