Лекция
Привет, Вы узнаете о том , что такое 19. Ароматические углеводороды. Бензол, строение молекулы, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое 19. Ароматические углеводороды. Бензол, строение молекулы , настоятельно рекомендую прочитать все из категории Общая химия.
Название «ароматические соединения» возникло потому, что первые известные представители этого класса, полученные еще в начале XIX века, обладали приятным запахом. Позднее оказалось, что большинство веществ, которые по строению и химическим свойствам принадлежат к этой же группе, не имеют приятного запаха. Однако исторически сложившееся общее название этих соединений сохранилось.
Простейшим представителем ароматических углеводородов является бензол. Его молекулярная формула C6H6.
Бензол — легкокипящая (tкип = 80 °С), бесцветная, нерастворимая в воде
жидкость с характерным запахом. При охлаждении бензол легко застывает в белую кристаллическую массу с температурой плавления 5,5 °С.
Открыл бензол великий английский физик Майкл Фарадей. В 1825 году ему удалось выделить бензол из каменноугольной смолы. Позже были установлены простейшая CH и молекулярная C6H6 формулы бензола. Однако долгое время не удавалось установить строение молекулы данного вещества. Через сорок лет после открытия бензола немецкий химик Август Кекуле сделал правильное предположение о циклическом строении молекулы бензола и предложил следующую структурную формулу:

Представленная формула бензола называется формулой Кекуле. Формула Кекуле показывает, что молекула бензола имеет плоское строение, валентные углы равны 120°. Из формулы Кекуле также следует, что для гидрирования молекулы бензола до циклогексана требуются три молекулы водорода:

Все эти выводы подтверждаются экспериментальными данными. Однако формула Кекуле не объясняет ряд особых свойств бензола. Так, бензол не вступает в качественные реакции на двойную  связь. Он, в отличие от алкенов, не обесцвечивает бромную воду и раствор перманганата калия. В присутствии катализатора бензол реагирует с галогенами, однако при этом происходит не присоединение галогена, а замещение атома водорода в молекуле бензола на галоген:
связь. Он, в отличие от алкенов, не обесцвечивает бромную воду и раствор перманганата калия. В присутствии катализатора бензол реагирует с галогенами, однако при этом происходит не присоединение галогена, а замещение атома водорода в молекуле бензола на галоген:
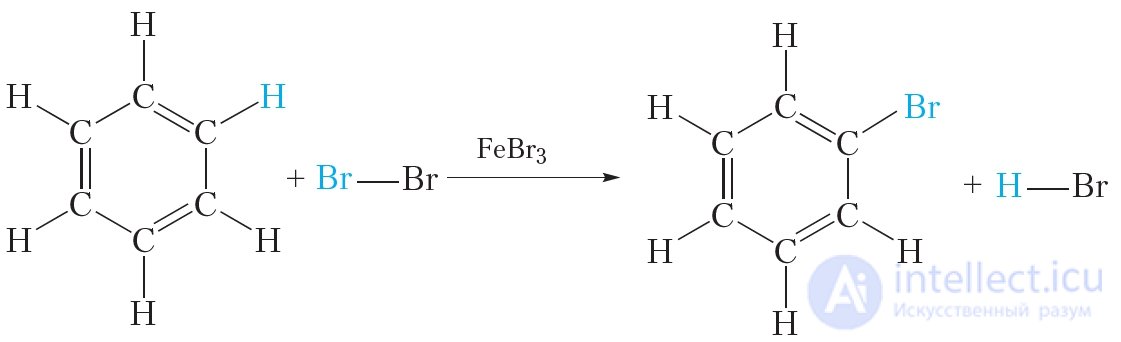
Кроме того, экспериментально установлено, что все связи углерод-углерод в молекуле бензола имеют одинаковую длину. Столь необычные свойства бензола удалось объяснить только в ХХ веке, используя современную теорию строения вещества.
Из формулы Кекуле следует, что двойные связи в молекуле бензола являются сопряженными. Об этом говорит сайт https://intellect.icu . На примере бутадиена-1,3 мы видели, что сопряжение ведет к некоторому выравниванию длин двойных и одинарных связей. В молекуле бензола сопряжение настолько сильное, что длины всех связей углерод-углерод становятся одинаковыми:
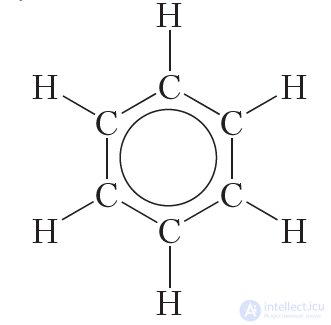
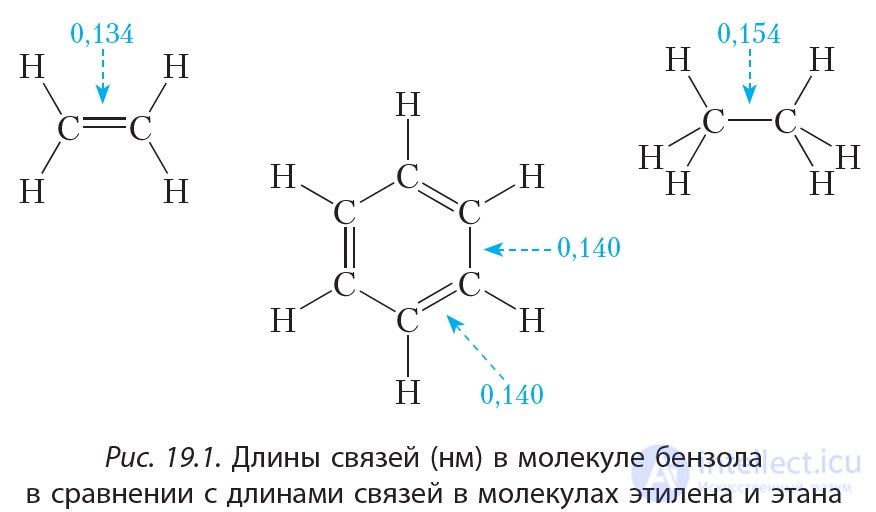 Таким образом, в молекуле бензола нет двойных и одинарных связей. Каждый атом углерода в молекуле бензола, как и в бутадиене-1,3, находится в состоянии sp2-гибридизации. π-Электроны делокализованы и образуют не три отдельные π-связи, а единую π-систему (сопряженную систему π-связей):
Таким образом, в молекуле бензола нет двойных и одинарных связей. Каждый атом углерода в молекуле бензола, как и в бутадиене-1,3, находится в состоянии sp2-гибридизации. π-Электроны делокализованы и образуют не три отдельные π-связи, а единую π-систему (сопряженную систему π-связей):

Наряду с формулой бензола, в которой показана делокализация π-электронов, нередко пользуются формулой Кекуле, учитывая при этом, что она не совсем точно передает строение бензола:

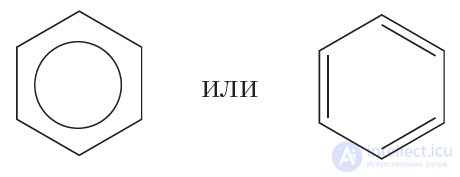
Делокализация π-электронов придает молекуле бензола дополнительную устойчивость. Поэтому для бензола характерны реакции, в которых сопряженная система π-связей в молекуле сохраняется. Такими реакциями являются реакции замещения (см. уравнение реакции с бромом).
Как уже отмечалось, бензол является простейшим представителем ароматических углеводородов. Его гомологи могут рассматриваться как продукты замещения одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы. Формулы и названия некоторых гомологов бензола приведены на рисунке 19.3.
Как видно, для построения названий веществ, в молекулах которых с бензольным кольцом соединено несколько углеводородных радикалов, атомы углерода бензольного кольца нумеруют таким образом, чтобы заместители получили наименьшие номера, и при помощи цифр в названии указывают положение заместителей.
|
Бензол С6Н6 — простейший представитель класса ароматических углеводородов. Молекула бензола имеет плоское строение, валентные углы равны 120°, длины всех связей углерод-углерод одинаковы. π-Электроны в молекуле бензола делокализованы и образуют единую сопряженную систему π-связей. Сопряженная система π-связей придает молекуле бензола повышенную устойчивость, поэтому для бензола характерны реакции, в которых сопряженная система сохраняется. |
1. В чем состоит главная особенность строения молекулы бензола? Почему бензол не вступает в качественные реакции на двойные C  C связи?
C связи?
2. Какие химические реакции (присоединения или замещения) более характерны для бензола и почему? Приведите уравнения реакций этена с бромной водой и бензола с бромом в присутствии катализатора.
3. Напишите структурную формулу ближайшего гомолога бензола — толуола. Сколько атомов углерода в молекуле толуола лежит в одной плоскости?
4. Среди веществ, приведенных на рисунке 19.3, укажите изомеры.
5. Выведите общую формулу гомологического ряда бензола.
6. В результате сжигания 1,17 г твердого при нормальных условиях углеводорода было получено 2,016 дм3 (н. у.) углекислого газа и 0,81 г воды. Углеводород не обесцвечивает бромную воду. Установите структурную формулу этого соединения.
Исследование, описанное в статье про 19. Ароматические углеводороды. Бензол, строение молекулы, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое 19. Ароматические углеводороды. Бензол, строение молекулы и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Общая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Органическая химия
Термины: Органическая химия