Лекция
Привет, Вы узнаете о том , что такое 1.2. Строение электронных оболочек атомов, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое 1.2. Строение электронных оболочек атомов , настоятельно рекомендую прочитать все из категории Общая химия.
Электроны в атомах занимают состояния с определенными энергиями (орбитали). Чтобы это показать, орбитали изображают в виде клеток  , а электроны — в виде стрелок
, а электроны — в виде стрелок  . Последнее позволяет отобразить такую характеристику электрона, как спин (от англ. spin — вращение). Чтобы понять, что такое спин, представим, что электрон в атоме не только движется вокруг ядра, но и вращается вокруг собственной оси. В зависимости от того, в какую сторону происходит вращение вокруг собственной оси (по часовой стрелке либо против), возможны два значения спина электрона. Электроны с противоположными спинами обозначают стрелками, направленными в разные стороны.
. Последнее позволяет отобразить такую характеристику электрона, как спин (от англ. spin — вращение). Чтобы понять, что такое спин, представим, что электрон в атоме не только движется вокруг ядра, но и вращается вокруг собственной оси. В зависимости от того, в какую сторону происходит вращение вокруг собственной оси (по часовой стрелке либо против), возможны два значения спина электрона. Электроны с противоположными спинами обозначают стрелками, направленными в разные стороны.
На одной орбитали могут разместиться не более двух электронов с противоположными спинами. Такие электроны называются спаренными. Два спаренных электрона образуют электронную пару:
 — заполненная орбиталь (электронная пара).
— заполненная орбиталь (электронная пара).
Если на орбитали имеется один электрон, то орбиталь называется частично или наполовину заполненной, а электрон — неспаренным:
 — частично или наполовину заполненная орбиталь (неспаренный электрон).
— частично или наполовину заполненная орбиталь (неспаренный электрон).
Орбитали с одинаковыми значениями энергии образуют энергетический подуровень. Энергетические подуровни обозначаются буквами s, p, d.
s-Подуровень состоит из одной орбитали , имеющей сферическую форму (рис. 1.7).
, имеющей сферическую форму (рис. 1.7).
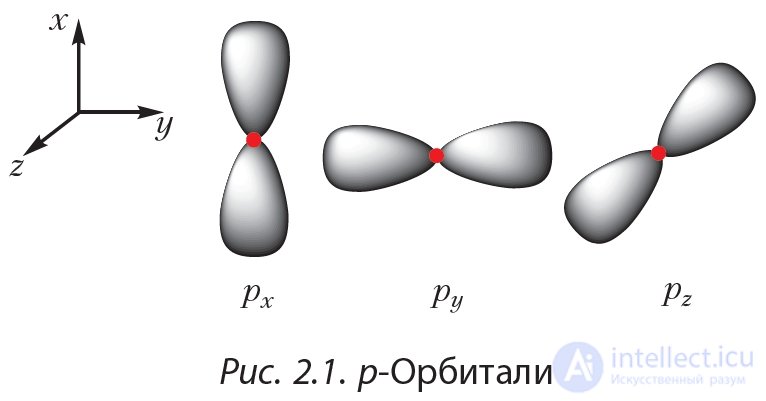
p-Подуровень состоит из трех орбиталей  , имеющих форму объемных восьмерок и ориентированных вдоль трех координатных осей (рис. 2.1).
, имеющих форму объемных восьмерок и ориентированных вдоль трех координатных осей (рис. 2.1).
d-Подуровень состоит из пяти орбиталей  , имеющих еще более сложную форму.
, имеющих еще более сложную форму.
Орбитали с близкими значениями энергии образуют энергетический уровень. На каждом энергетическом уровне имеется строго определенное число подуровней и, следовательно, орбиталей, причем их число увеличивается с возрастанием номера энергетического уровня (рис. 2.2).
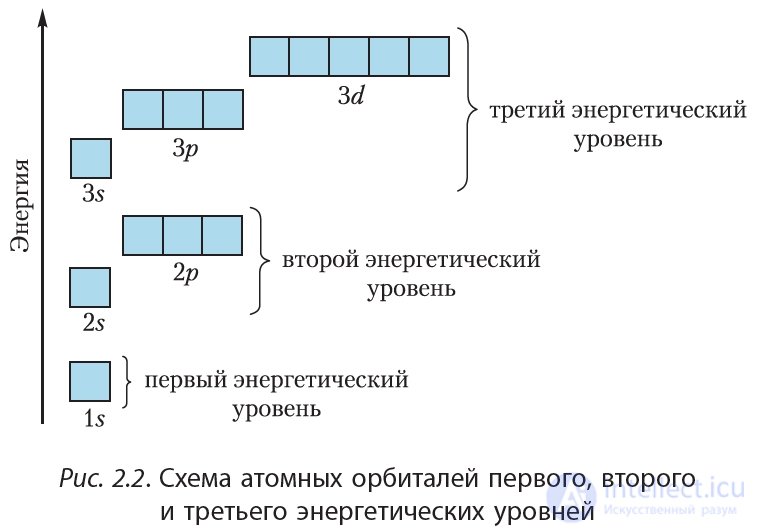

 и 2p
и 2p
третий — из трех подуровней — 3s 3p
3p и 3d
и 3d
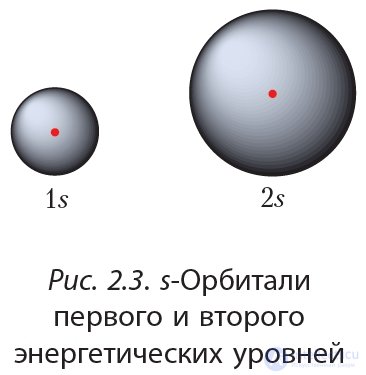 С увеличением номера энергетического уровня размеры орбиталей увеличиваются, значения энергии электронов, занимающих эти орбитали, возрастают. Сравните размеры 1s и 2s-орбиталей (рис. 2.3).
С увеличением номера энергетического уровня размеры орбиталей увеличиваются, значения энергии электронов, занимающих эти орбитали, возрастают. Сравните размеры 1s и 2s-орбиталей (рис. 2.3).
Электроны в атоме стремятся занимать состояния с наименьшей энергией.
Расположение электронов на атомных орбиталях отражает электронно-графическая схема.
Приведем электронно-графические схемы некоторых атомов. При этом будем учитывать, что сначала заполняются уровни и подуровни с меньшей энергией (рис. 2.2).
Элемент с атомным номером 1 — водород (Н). Заряд ядра атома водорода равен 1+, поэтому в атоме водорода имеется один электрон, который располагается на орбитали с наименьшей энергией 1s.
Электронно-графическая схема атома водорода:

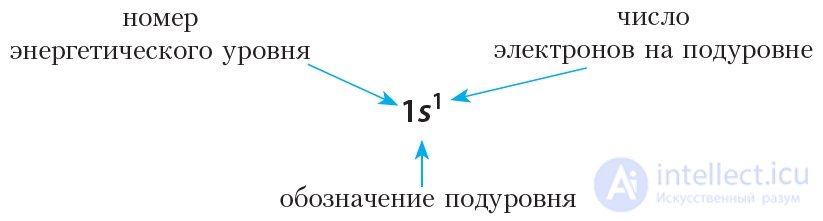
На практике пользоваться электронно-графической схемой не всегда удобно, проще для отображения строения электронной оболочки атома воспользоваться формулой электронной конфигурации (ее также называют электронной конфигурацией).
Например, формула электронной конфигурации водорода:
Элемент с атомным номером 2 — гелий (Не). Формула электронной конфигурации:
Не: 1s2
Первый энергетический уровень в атоме гелия завершен. Завершенная электронная оболочка устойчива, поэтому гелий не образует химических соединений, является благородным газом, существует в виде отдельных атомов (одноатомных молекул). Другие благородные газы — Ne, Ar и т. д. — также имеют устойчивые завершенные электронные оболочки.
Атомы остальных элементов не имеют завершенных оболочек, поэтому они образуют химические соединения. В этих соединениях атомы приобретают завершенные оболочки ближайших благородных газов.
Элемент с атомным номером 3 — литий (Li). Его электронная конфигурация:
Li: 1s22s1
Из электронной конфигурации атома лития видно, что, отдав один внешний электрон, атом приобретет завершенную электронную оболочку, как и у атома гелия. Для лития характерны реакции, в которых он отдает один электрон, то есть проявляет восстановительные свойства. В образующихся соединениях степень окисления лития равна +1:

Элемент с атомным номером 4 — бериллий (Ве). Об этом говорит сайт https://intellect.icu . Формула электронной конфигурации:
Ве: 1s22s2
На первый взгляд может показаться, что строение внешнего энергетического уровня атома бериллия такое же, как у атома гелия, но свойства этих элементов совершенно различны. Бериллий — двухвалентный металл, в то время как гелий — благородный газ.
Рассмотрим электронно-графическую схему атома бериллия. Внутреннюю 1s-орбиталь приводить не будем, вместо нее на схеме многоточие. Напомним, что химические свойства атома определяются строением внешнего энергетического уровня. Электронно-графическая схема внешнего энергетического уровня атома бериллия имеет вид:

В отличие от атома гелия, внешний энергетический уровень атома бериллия не завершен. Чтобы приобрести устойчивую завершенную электронную оболочку, атом бериллия должен отдать два электрона, поэтому бериллий проявляет в соединениях степень окисления +2, его оксид имеет формулу ВеО, а гидроксид — Ве(ОН)2.
Элемент с атомным номером 5 — бор (B). Его электронная конфигурация: В: …2s22p1
Следующий элемент — углерод (С). Электронно-графическая схема и электронная конфигурация углерода:

С: …2s22p2
Как видно из электронно-графической схемы, электроны в атоме углерода заполняют разные 2р-орбитали. Это объясняется тем, что, находясь на одной орбитали, одноименно заряженные электроны испытывают электростатическое отталкивание, которое уменьшается, если электроны находятся на разных орбиталях.
Приведем электронно-графические схемы и электронные конфигурации атомов остальных элементов второго периода:
 или N: …2s22p3
или N: …2s22p3
 или О: …2s22p4
или О: …2s22p4
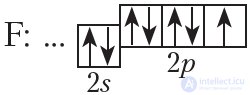 или F: …2s22p5
или F: …2s22p5
Последний элемент второго периода — неон (Ne) — имеет завершенную электронную оболочку:
Ne: …2s22p6
Каждая из приведенных электронно-графических схем отражает наиболее энергетически выгодное состояние атома (ему соответствует наименьшая энергия). Такое состояние называется основным.
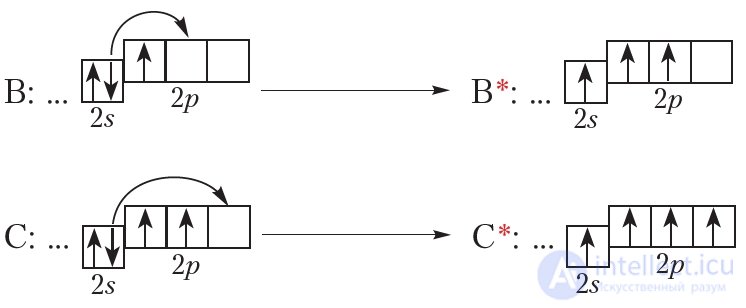
Поглощая энергию, атом может переходить в возбужденное состояние, при этом один или несколько электронов переходят с одной орбитали на другую (рис. 1.6). Энергия атома в возбужденном состоянии выше, чем в основном, поэтому в возбужденном состоянии атом может находиться очень недолго и быстро возвращается в основное состояние.
Приведем примеры возбужденных состояний атомов (обозначены *):
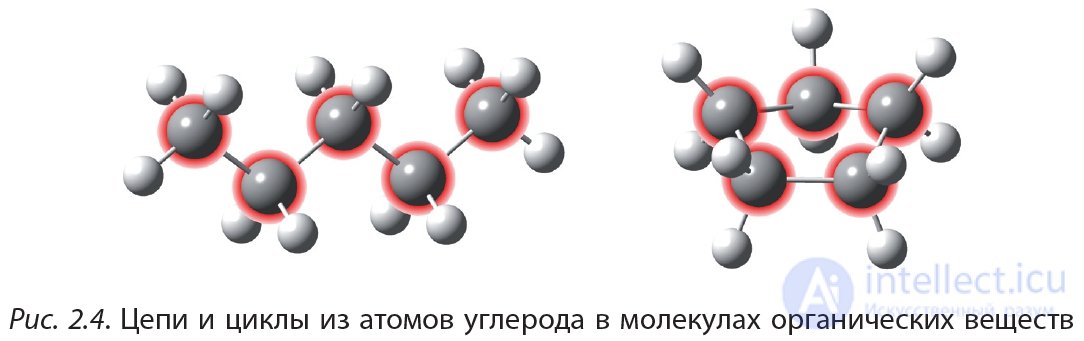
В 10-м классе вы будете изучать органическую химию — химию соединений углерода. Уникальность этого элемента заключается в том, что число электронов на внешнем энергетическом уровне углерода (их четыре) равно числу орбиталей (которых также четыре). То есть у атома углерода внешний энергетический уровень заполнен ровно наполовину. В таком случае атому невыгодно как отдавать, так и принимать электроны, а выгодно их обобществлять, образуя ковалентные связи. Поэтому атомы углерода образуют достаточно прочные связи друг с другом, соединяясь в длинные цепи или циклы. При этом каждый атом углерода образует четыре ковалентные связи.
На рисунке 2.4 показаны цепи и циклы из атомов углерода в молекулах органических веществ. Свободные валентности атомов углерода заполнены атомами водорода (белые шарики):
 Неудивительно, что углерод является основой множества органических соединений. Валентность углерода, равная четырем, дает возможность образования разветвленных структур и кратных (двойных и тройных) связей, что обусловливает многообразие органических соединений.
Неудивительно, что углерод является основой множества органических соединений. Валентность углерода, равная четырем, дает возможность образования разветвленных структур и кратных (двойных и тройных) связей, что обусловливает многообразие органических соединений.
Со строением атомов химических элементов третьего периода вы можете познакомиться, перейдя по ссылке в QR-коде.
|
Строение электронной оболочки атома отображают при помощи электронно-графической схемы или формулы электронной конфигурации. При составлении электронно-графической схемы учитывают, что в первую очередь электронами заполняются орбитали с наименьшей энергией и на одной орбитали могут разместиться не более двух электронов с противоположными спинами. В атоме углерода число электронов на внешнем энергетическом уровне равно числу орбиталей, поэтому атомы углерода способны образовывать достаточно прочные ковалентные связи друг с другом, соединяясь в длинные цепи и циклы. |
Первый элемент третьего периода — натрий. Его электронная конфигурация:
Na: …3s1
Как видно, конфигурация внешнего электронного слоя натрия повторяет таковую для лития — в атомах обоих элементов на внешнем слое имеется один s-электрон, который атом легко отдает при образовании соединений. Литий и натрий относятся к семейству щелочных металлов. Так как конфигурация внешнего электронного слоя натрия и лития одинаковая, то химические свойства этих металлов во многом подобны. Формулы электронных конфигураций атомов щелочных металлов могут быть выражены в общем виде: …ns1 (где n = 2 для лития, n = 3 для натрия и т. д.). На примере лития и натрия видно, что с увеличением заряда ядер атомов электронные конфигурации внешнего энергетического уровня периодически повторяются, поэтому периодически повторяются свойства химических элементов.
Следующий элемент № 12 — магний. Его электронная конфигурация:
Mg: …3s2
Подобно бериллию, магний — металл, проявляющий в соединениях степень окисления +2. Но поскольку валентные электроны магния находятся на третьем энергетическом уровне и располагаются дальше от ядра, чем валентные электроны бериллия, металлические свойства магния выражены сильнее, чем у бериллия. Это отражается и на характере соединений. Если оксид и гидроксид бериллия проявляют амфотерные свойства, MgO является основным оксидом, а Mg(OH)2 — основанием.
Элемент № 13 — алюминий. Al: …3s23p1. Алюминий так же, как и бор, проявляет в соединениях степень окисления +3, но, в отличие от последнего, является металлом. Оксид алюминия Al2O3 и гидроксид алюминия Al(OH)3 амфотерны.
Электронная конфигурация внешнего слоя элемента № 14 кремния повторяет таковую для углерода:
Si: …3s23p2
Кремний — неметалл. Его оксид SiO2 является кислотным оксидом, а гидроксид H2SiO3 — кислотой.
Элемент № 15 фосфор имеет такую же электронную конфигурацию внешнего электронного слоя, как и азот. Но в отличие от атома азота, атом фосфора, благодаря наличию на внешнем энергетическом уровне 3d-орбиталей, может легко переходить в возбужденное состояние, в котором имеется пять неспаренных электронов:
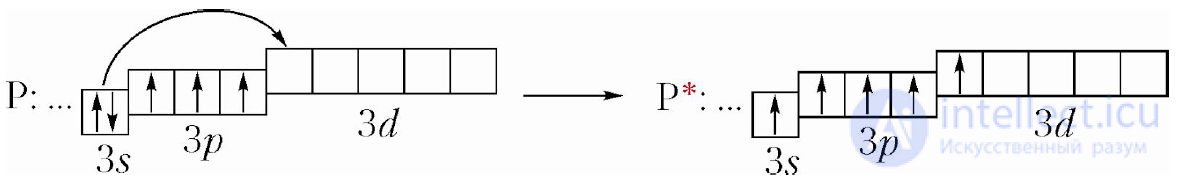
Р: …3s23p3  P*: …3s13p33d1
P*: …3s13p33d1
Валентность фосфора может быть равна III и V. Валентность III фосфор проявляет в кислотном оксиде P2O3. Валентность V — в кислотном оксиде P2O5 и фосфорной кислоте Н3РО4.
Элементы, которые могут проявлять различные валентности, называются поливалентными.
Элемент № 16 — сера. Электронная конфигурация серы:
S: …3s23p4
Как и атом фосфора, благодаря наличию d-орбиталей атом серы может легко переходить в возбужденные состояния:
S: …3s23p4  S*: …3s23p33d1
S*: …3s23p33d1  S** …3s13p33d2
S** …3s13p33d2
В основном состоянии у атома серы имеются два неспаренных электрона, поэтому сера может проявлять валентность II (например, в сероводороде H2S). В первом возбужденном состоянии у атома серы имеются четыре неспаренных электрона, следовательно, сера может проявлять валентность IV (SO2, Н2SO3). Второе возбужденное состояние атома серы характеризуется наличием шести неспаренных электронов. Примеры соединений, в которых валентность серы равна VI: SO3, серная кислота H2SO4.
Следующим элементом является хлор. Атомный номер — 17, электронная конфигурация:
Cl: …3s23p5
В основном состоянии у атома хлора, как и у его электронного аналога фтора, имеется один неспаренный электрон. Примеры соединений, в которых хлор одновалентен: простое вещество Cl2, хлороводород HCl. Но, благодаря наличию d-орбиталей на третьем энергетическом уровне, атом хлора, как и атомы фосфора и серы, может легко переходить в возбужденные состояния:
Cl: …3s23p5  Cl*: …3s23p43d1
Cl*: …3s23p43d1  Cl**: …3s23p33d2
Cl**: …3s23p33d2  Cl***: …3s13p33d3
Cl***: …3s13p33d3
Поэтому хлор может проявлять в соединениях валентности I, III, V, VII. Примеры соединений, где валентность хлора III, V и VII:

Завершается формирование 3s- и 3p-подуровней у элемента № 18 — аргона:
Ar: …3s23p6
Восьмиэлектронная оболочка аргона так устойчива, что, несмотря на наличие 3d-орбиталей, его атомы не принимают участия в образовании химических связей и аргон — инертный газ.
1. Сколько электронов может располагаться на одной орбитали?
2. Сколько орбиталей имеется на первом и на втором энергетических уровнях соответственно?
3. Определите степени окисления элементов в следующих соединениях: HF, H2SO4, H2, NH3, CH4.
4. Почему бериллий, имеющий электронную конфигурацию 1s22s2, является активным металлом, тогда как гелий с похожей электронной конфигурацией внешнего энергетического уровня (1s2) — благородным газом?
5. В чем уникальность строения атома углерода, позволяющего ему быть основой для молекул миллионов органических соединений?
6. Химический элемент, электронная конфигурация которого …2s22p2, образует оксид, массовая доля кислорода в котором равна 72,7 %. Приведите химический символ элемента и формулу оксида.
7. Какие из приведенных электронных конфигураций соответствуют основному состоянию атома, а какие — возбужденному:
а) 1s22s22p2; б) 1s22s12p2; в) 1s22s22p5; г) 1s22s22p6; д) 1s22s12p3?
8*. Почему такие элементы, как сера, фосфор, хлор, являются поливалентными?
Исследование, описанное в статье про 1.2. Строение электронных оболочек атомов, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое 1.2. Строение электронных оболочек атомов и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Общая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Органическая химия
Термины: Органическая химия