Лекция
Это окончание невероятной информации про теория атома.
...
Поэтому для оценки эффективного заряда у ядра мы возьмем среднее арифметическое:
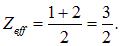
Конечно, электрон не может полностью экранировать ядро от своего партнера. Конечно, надо принять во внимание энергию кулоновского отталкивания электронов. И все же получающаяся оценка не столь плоха:
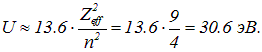
Эксперимент дает

Бросается в глаза огромная величина ионизационного потенциала у гелия (самый большой в таблице Менделеева). Инертность гелия — прямое следствие этого факта.
Дважды ионизованный атом лития  . Водородоподобная система с Z = 3. Поэтому
. Водородоподобная система с Z = 3. Поэтому

Ион лития. Ион  подобен атому гелия, но для него эффективный заряд ядра на единицу больше:
подобен атому гелия, но для него эффективный заряд ядра на единицу больше:
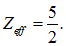
Отсюда
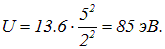
Эксперимент дает
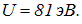
Литий. Третий электрон в нейтральном атоме лития располагается на второй оболочке — уровне с n = 2. По этой причине два внутренних электрона почти полностью экранируют от него две единицы заряда ядра:

Отсюда

Эксперимент дает
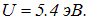
Эти оценки очень показательны: насколько легче (в сравнении с водородом) оторвать от лития один электрон и как трудно удалить последующие. Поэтому литий — одновалентен.
Бериллий. Ионы 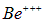 и
и 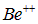 аналогичны водороду и гелию и имеют огромные потенциалы ионизации. Ион
аналогичны водороду и гелию и имеют огромные потенциалы ионизации. Ион 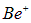 похож на литий, но у него на единицу больше эффективный заряд ядра, «видимый» третьим электроном:
похож на литий, но у него на единицу больше эффективный заряд ядра, «видимый» третьим электроном:
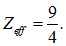
Получаем

Эксперимент дает 18,2 эВ. Это значение не намного больше потенциала ионизации атома водорода и заведомо много меньше потенциала ионизации иона 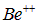 . В нейтральном атоме Be на второй оболочке помещаются два электрона. Система похожа на ион
. В нейтральном атоме Be на второй оболочке помещаются два электрона. Система похожа на ион  , но эффективный заряд ядра на единицу больше:
, но эффективный заряд ядра на единицу больше:

Отсюда

Экспериментальное значение 10,4 эВ. Отсюда вывод: поскольку первые два электрона вырвать из атома бериллия гораздо легче, чем последующие, то бериллий — двухвалентен.
Понятие эффективного заряда ядра полезно также при рассмотрении свойств так называемого характеристического рентгеновского излучения, возникающего при переходе внешних электронов на свободное место на внутренних оболочках. Как мы выяснили, для электронов на КК оболочке

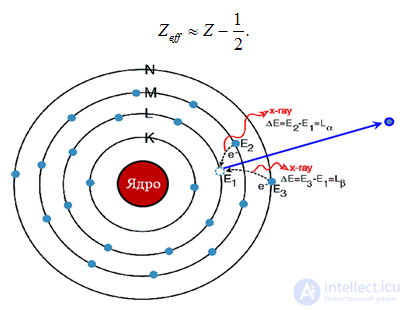
Рис. 5.29. Происхождение характеристического излучения. При столкновении с электроном в атоме мишени образуется вакансия во внутренней электронной оболочке. Эту вакансию заполняет электрон из другой оболочки. При этом излучается рентгеновский квант
Пример. Для меди Сu Z = 29 и
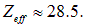
При переходе внешних, далеких от ядра электронов с энергией, почти равной нулю, испускается фотон с энергией
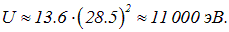
Длина волны такого фотона

В 1913 г. был установлен закон Мозли, связывающий частоту n характеристического рентгеновского излучения элемента и его атомный номер Z:
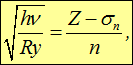
где 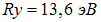 — Ридберг, n — главное квантовое число оболочки, на которую совершается переход, а
— Ридберг, n — главное квантовое число оболочки, на которую совершается переход, а 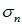 — некая постоянная. В этом законе легко теперь увидеть проявление экранирования ядра, то есть влияние на отдельный электрон атома всех остальных электронов. Исторически закон Мозли окончательно подтвердил, что свойства элемента зависят от атомного номера Z, а не от атомной массы. Это устранило последние сомнения в правильности расположения элементов в периодической системе.
— некая постоянная. В этом законе легко теперь увидеть проявление экранирования ядра, то есть влияние на отдельный электрон атома всех остальных электронов. Исторически закон Мозли окончательно подтвердил, что свойства элемента зависят от атомного номера Z, а не от атомной массы. Это устранило последние сомнения в правильности расположения элементов в периодической системе.
Рис. 5.30. Закон Мозли подтвердил правильность размещения элементов в таблице Д.И. Менделеева и содействовал выяснению физического смысла Z
Видео 5.8. Экспериментальная проверка закона Мозли.

Рис. 5.31. Ге́нри Гвин Дже́фрис Мо́зли, 1887–1915
Электронная конфигурация атомов
Для атома любого элемента мы можем указать его основную электронную конфигурацию. Теперь познакомимся с двумя правилами, позволяющими узнать для основного состояния каждого атома значение его суммарных моментов: спинового S, орбитального L и полного J.
Первое правило (правило Хунда)
|
Наименьшей энергией обладает атом с наибольшим возможным при данной электронной конфигурации значением S и наибольшим возможным при этом S значением L. |
Второе правило
|
Если в незаполненной подоболочке атома находится не более половины максимально возможного для нее числа электронов, то J = |L – S|. Если же подоболочка заполнена более чем наполовину, то J = L + S. |
Правило Хунда является эмпирическим (то есть не выведенным из теории, а установленным экспериментально); второе правило выводится из него и из полученной выше формулы (5.19) для скалярного произведения S·L. Для облегчения применения правила Хунда полезно запомнить, что:
Для примера применения указанных правил рассмотрим атом серы. Его атомный номер Z = 16 и, следовательно, основная электронная конфигурация имеет вид 1s2 2s2 2p6 3s2 3p4. Индексы справа вверху обозначают числа электронов в указанных состояниях. Видим, что незаполненной остается последняя подоболочка, на которой находятся четыре электрона с орбитальными моментами, равными единице. При данном L = 1 , согласно принципу Паули, параллельными могут быть лишь спины трех электронов, отличающихся значениями m = –1, 0, +1. Спин четвертого электрона должен быть направлен в противоположную сторону, и потому максимально возможное значение суммарного спина для данной конфигурации равно

При этом значении S сумма проекций орбитальных моментов электронов с одинаково направленными спинами равна нулю, следовательно, максимально возможное значение проекции суммарного орбитального момента определяется четвертым электроном и равно единице. Поэтому L = 1. Так как внешняя подоболочка заполнена более чем наполовину, то J = L + S = 2. Мы пришли к выводу, что основным состоянием атома серы является  .
.
Для сравнения найдем основное состояние атома кремния (Z = 14). От атома серы он отличается тем, что на внешней подоболочке у него находятся два, а не четыре p-электрона. Для ее заполнения не хватает четырех электронов, то есть столько, сколько их имеется у серы. Поэтому для атома кремния получаем те же значения S = 1 и L = 1. Внешняя подоболочка заполнена менее чем наполовину, откуда J = |L – S| = 0. Поэтому основным состоянием кремния является 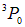 .
.

Рис. 5.32. Фридрих Хунд, 1896–1997
Исследование, описанное в статье про теория атома, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое теория атома и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Атомная и Ядерная физика
Часть 1 5. Теория атома
Часть 2 5.4. Спин электрона и тонкая структура спектров - 5. Теория
Часть 3 5.6. Принцип Паули и валентность элементов - 5. Теория атома
Часть 4 - 5. Теория атома
Комментарии
Оставить комментарий
Базовая физика
Термины: Базовая физика