Лекция
Это продолжение увлекательной статьи про теория атома.
...
Найдем силу, действующую на диполь. На положительный заряд действует сила

на отрицательный —
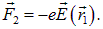
Результирующая сила будет
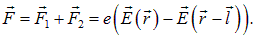
Так как расстояние между зарядами мало, то поле в точке расположения отрицательного заряда можно приближенно записать как
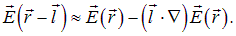
Подставляя это разложение в выражение для силы F, находим
|
|
|
(5.14) |
Если поле однородно (Е не зависит от  ), то на заряды диполя действуют равные и противоположно направленные силы и результирующая сила равна нулю, как и следует из уравнения (5.14). Как известно, такая пара сил не смещает диполь (который в целом электрически нейтрален), но лишь поворачивает его вдоль поля (магнитный аналог — стрелка компаса). В неоднородном же поле результирующая сила отлична от нуля. В частном случае, когда поле
), то на заряды диполя действуют равные и противоположно направленные силы и результирующая сила равна нулю, как и следует из уравнения (5.14). Как известно, такая пара сил не смещает диполь (который в целом электрически нейтрален), но лишь поворачивает его вдоль поля (магнитный аналог — стрелка компаса). В неоднородном же поле результирующая сила отлична от нуля. В частном случае, когда поле 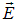 зависит только от координаты z, в уравнении (5.14) отлична от нуля лишь производная по z
зависит только от координаты z, в уравнении (5.14) отлична от нуля лишь производная по z
|
|
|
(5.15) |
где 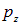 — проекция электрического момента на ось z. Неоднородное поле стремится втянуть диполь в область, где оно сильнее.
— проекция электрического момента на ось z. Неоднородное поле стремится втянуть диполь в область, где оно сильнее.
Магнитных зарядов не существует, но магнитный диполь реализуется витком с током, и его свойства аналогичны свойствам электрического диполя. Поэтому в формуле (5.15) надо заменить электрическое поле на магнитное, электрический момент — на магнитный и написать для силы, действующей на электрон в опыте Штерна — Герлаха, аналогичное выражение
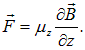
Схема опыта: пучок атомов пролетает сквозь неоднородное магнитное поле, направленное поперечно к скорости атомов. Сила, действующая на магнитные моменты атомов, отклоняет их. Соответственно возможным значениям проекции магнитного момента на направление поля первоначальный пучок расщепляется на несколько пучков. Если полный магнитный момент атома определяется только спином электрона, то первоначальный пучок расщепится на два. Для многоэлектронных атомов расщепленных пучков может быть больше. Для своего эксперимента Штерн и Герлах использовали серебро, которое испарялось в электрической печке. Численные значения расщепления составляли доли миллиметра. Авторы подчеркнули в своих выводах, что неотклоненных атомов не было зарегистрировано. Ниже мы увидим, что это — специфика опытов с элементами первой группы.
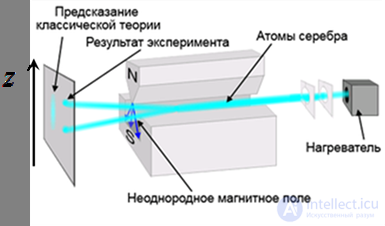
Рис. 5.16. Схема опыта Штерна и Герлаха
Главный результат опытов Штерна и Герлаха — прямое экспериментальное доказательство квантования направления магнитного момента атомов. Согласно классической физике, первоначальный пучок должен не расщепиться, а размазаться в соответствии с произвольностью проекции магнитного момента на направление магнитного поля. Соответственно, на экране за прибором вместо двух раздельных линий, оставленных атомами серебра, должна была бы наблюдаться размытая полоска.

Рис. 5.17. Отто Штерн, 1888–1969
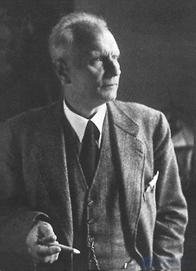
Рис. 5.18. Ва́льтер Ге́рлах, 1889–1979
Пример 2. Узкий пучок атомов со скоростью 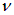 и массой n пропускается через поперечное неоднородное магнитное поле, в котором на них действует сила
и массой n пропускается через поперечное неоднородное магнитное поле, в котором на них действует сила  (рис. 5.19). Протяженность области поля
(рис. 5.19). Протяженность области поля  , расстояние от магнита до экрана
, расстояние от магнита до экрана 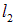 . Определим угол отклонения
. Определим угол отклонения 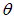 следа пучка атомов на экране от его положения при выключенном магнитном поле.
следа пучка атомов на экране от его положения при выключенном магнитном поле.
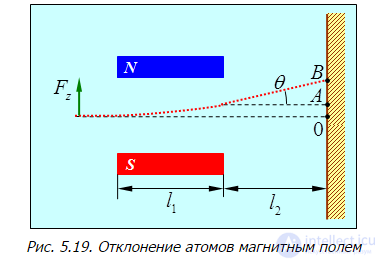
Рис. 5.19. Отклонение атомов магнитным полем
Здесь мы имеем дело с задачей классической механики, которая позволяет подготовиться к количественному рассмотрению опыта Штерна — Герлаха. Время пролета атома через магнит равно

Все это время на атом действует поперечная сила  , придающая ему поперечное ускорение
, придающая ему поперечное ускорение
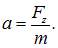
За время пролета атом отклонится на расстояние
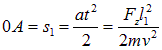
и приобретет поперечную скорость

Это значит, что из магнита атом вылетает под углом 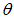 к первоначальному направлению движения, причем
к первоначальному направлению движения, причем
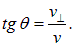
Следовательно, при пролете расстояния l2 до экрана атом отклонится еще и на расстояние

Складывая отклонения  и
и  , получаем искомое отклонение следа атома на экране
, получаем искомое отклонение следа атома на экране
|
|
|
(5.16) |
Часто в задаче стоит вопрос об отклонении пучка атомов при выходе из магнита. В таком случае надо положить  в полученной формуле (5.16).
в полученной формуле (5.16).
Пример 3. Узкий пучок атомов серебра при прохождении магнитного поля с неоднородностью
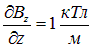
протяженностью  см расщепился на два пучка. Экран для наблюдения установлен на расстоянии
см расщепился на два пучка. Экран для наблюдения установлен на расстоянии  см, скорость атомов
см, скорость атомов  км/с. Определим расстояние b между компонентами расщепленного пучка на экране.
км/с. Определим расстояние b между компонентами расщепленного пучка на экране.
Заполненные оболочки дают нулевой вклад в магнитный момент атома. Атом серебра имеет один валентный электрон (в основном состоянии l = 0) и потому его магнитный момент равен собственному магнитному моменту электрона. В неоднородном поле на атом действует сила
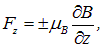
где 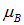 — магнетон Бора. Знаки
— магнетон Бора. Знаки 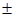 соответствуют двум возможным направлениям магнитного момента электрона, и потому пучок расщепляется на два. На экране наблюдаются две полоски, находящиеся на расстоянии b друг от друга. Если в формулу (5.16) подставить выражение для силы
соответствуют двум возможным направлениям магнитного момента электрона, и потому пучок расщепляется на два. На экране наблюдаются две полоски, находящиеся на расстоянии b друг от друга. Если в формулу (5.16) подставить выражение для силы  , то получим два отклонения s, отличающиеся знаком. Поэтому искомое расщепление b = 2s. В результате приходим к выражению
, то получим два отклонения s, отличающиеся знаком. Поэтому искомое расщепление b = 2s. В результате приходим к выражению
|
|
|
(5.17) |
Массу атома серебра легко найти по таблице Менделеева: молярная (атомная) масса М = 107,868 г/моль. Чтобы найти массу атома, надо молярную массу М разделить на число Авогадро:

Подставим теперь в (5.17) численные значения:
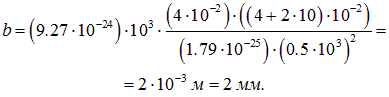
Такое расщепление вполне наблюдаемо в опытах.

Рис. 5.20. Мемориальная доска во Франкфуртском университете, посвященная опыту Штерна и Герлаха
Обсудим качественные изменения, вносимые спином электрона в теорию атома. Полный момент импульса J складывается теперь из орбитальной L и спиновой S частей. Возникает новое квантовое число j, принимающее для одноэлектронного атома два значения

(при l = 0 полный момент импульса j = 1/2). Эти значения соответствуют двум случаям, когда спин параллелен и антипараллелен орбитальному моменту импульса. Необходимо ввести новые обозначения уровней: добавляется индекс, указывающий величину полного момента импульса: уровни обозначают  , где n — главное квантовое число, а х — прежний спектроскопический символ для обозначения величины азимутального квантового числа l. Свойства полного момента те же, что и у орбитального и спинового моментов. Как следствие нового вида взаимодействия возникает более богатая структура атомных спектров, наблюдавшаяся на опыте. Проиллюстрируем это на примере первых возбужденных уровней атома водорода (см. табл.).
, где n — главное квантовое число, а х — прежний спектроскопический символ для обозначения величины азимутального квантового числа l. Свойства полного момента те же, что и у орбитального и спинового моментов. Как следствие нового вида взаимодействия возникает более богатая структура атомных спектров, наблюдавшаяся на опыте. Проиллюстрируем это на примере первых возбужденных уровней атома водорода (см. табл.).
Таблица
Схема нижних уровней атома водорода
|
n = 1 |
l = 0 |
j = 1/2 |
1s1/2 |
|
n = 2 |
l = 0 |
j = 1/2 |
2s1/2 |
|
l = 1 |
j = 1/2 |
2p1/2 |
|
|
j = 3/2 |
2p3/2 |
||
|
n = 3 |
l = 0 |
j = 1/2 |
3s1/2 |
|
l = 1 |
j = 1/2 |
3p1/2 |
|
|
j = 3/2 |
3p3/2 |
||
|
l = 2 |
j = 3/2 |
3d3/2 |
|
|
j = 5/2 |
3d5/2 |
Энергия уровней уже выражается не формулой Бора, но содержит поправки, относительная величина которых порядка величины  . Мы не станем приводить эту формулу, но отметим ее характерное свойство: в отсутствие внешних полей энергия по-прежнему не зависит от орбитального момента (квантового числа l ), но лишь от полного момента импульса (квантового числа j). Значит, уровни
. Мы не станем приводить эту формулу, но отметим ее характерное свойство: в отсутствие внешних полей энергия по-прежнему не зависит от орбитального момента (квантового числа l ), но лишь от полного момента импульса (квантового числа j). Значит, уровни  и
и  вырождены (их энергии совпадают). Уровень
вырождены (их энергии совпадают). Уровень  , как оказывается, лежит чуть выше.
, как оказывается, лежит чуть выше.
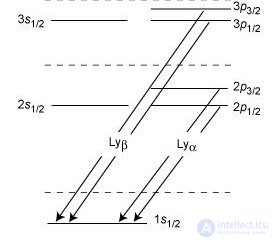
Рис. 5.21. Дублетная структура серии Лаймана
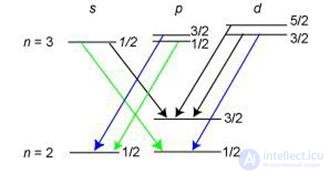
Рис. 5.22. Схема переходов, определяющих тонкую структуру линии 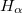 серии Бальмера
серии Бальмера
Состояния многоэлектронных атомов классифицируются подобным образом. Если L — суммарный орбитальный момент всех электронов, а S — их суммарный спиновый момент, то полный момент системы определяется как
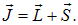
Соответственно и обозначается это состояние как  . Под X понимается тот же буквенный (спектроскопический) символ, обозначающий значение орбитального момента количества движения (только в этом случае используется заглавная буква). Верхний левый индекс равен числу спиновых состояний (для одиночного электрона в нем не было необходимости, так как его спин всегда равен 1/2).
. Под X понимается тот же буквенный (спектроскопический) символ, обозначающий значение орбитального момента количества движения (только в этом случае используется заглавная буква). Верхний левый индекс равен числу спиновых состояний (для одиночного электрона в нем не было необходимости, так как его спин всегда равен 1/2).
Итак, пусть дано состояние 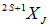 . Возникает вопрос: чему равен магнитный момент системы
. Возникает вопрос: чему равен магнитный момент системы  ? Ясно, что он направлен вдоль полного момента количества движения J, а его размерность и порядок величины определяется магнетоном Бора
? Ясно, что он направлен вдоль полного момента количества движения J, а его размерность и порядок величины определяется магнетоном Бора 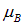 . Тогда
. Тогда
|
|
|
(5.18) |
Для гиромагнитного отношения (обобщение аналогичной величины, связанной с орбитальным и спиновым моментами) можно тогда написать выражение вида

Коэффициент пропорциональности g называется множителем Ланде или просто g-фактором. Для орбитального магнитного момента g = 1, для спинового магнитного момента g = 2. Задача о магнитном моменте атома сводится к нахождению зависимости g от квантовых чисел J, L, S.

Рис. 5.23. Альфред Ланде, 1888–1976.
Ответ можно получить с помощью простой полуклассической модели, получившей название векторной модели атома. Сначала возведем в квадрат уравнение, связывающее J с L и S:

Квадраты моментов можно выразить через соответствующие квантовые числа по уже известным нам правилам. Находим тогда выражение для скалярного произведения
|
|
|
(5.19) |
Полный магнитный момент атома складывается из магнитного момента, создаваемого суммарным орбитальным моментом количества движения, и суммарного спинового магнитного момента. Но спин, как уже говорилось, обладает двойным магнетизмом. Поэтому с учетом уравнения (5.18) можно записать

Сокращая общий множитель 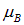 и умножая обе части на
и умножая обе части на

(в правой части J заменен на L + S), получаем
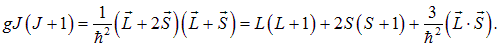
Если подставить сюда выражение (5.19) для скалярного произведения L·S, то получим окончательный ответ
|
|
|
(5.20) |
Убедимся, что эта формула воспроизводит уже известные результаты. Если полный спиновый момент равен нулю, то полный момент совпадает с орбитальным. Подставляя в (5.20) значения S = 0, J = L, получаем g = 1, как и должно быть для магнитного момента, создаваемого чисто орбитальным движением электронов. В другом предельном случае нулю равен орбитальный момент, и полный момент количества движения равен спиновому. Подставляя в (5.20) значения L = 0, J = S, находим g = 2 в полном согласии с двойным магнетизмом спинового момента. Именно такой случай реализуется для элементов первой группы в опыте Штерна — Герлаха. Упоминалось, что для сложных атомов (например, серы) расщепление пучков будет более сложным. Теперь мы можем предсказать результат опыта количественно. Основное состояние серы  , то есть S = 1, L = 1, J = 2. Из формулы (5.20) для множителя Ланде легко получаем g = 3/2, так что магнитный момент атома равен
, то есть S = 1, L = 1, J = 2. Из формулы (5.20) для множителя Ланде легко получаем g = 3/2, так что магнитный момент атома равен

Проекция магнитного момента на ось z

определяется квантовым числом  проекции полного момента количества движения, которое при J = 2 принимает пять различных значений в соответствии с правилами квантования момента:
проекции полного момента количества движения, которое при J = 2 принимает пять различных значений в соответствии с правилами квантования момента:

Теперь, используя решение примера 3 в разделе 5.4, можно рассчитать расщепление пучка атомов серы в опыте Штерна — Герлаха. Ясно, что пучок расщепится на пять компонентов, причем одна из них  не будет отклоняться магнитным полем.
не будет отклоняться магнитным полем.
Мы видели, что орбитальный момент импульса характеризуется азимутальным квантовым числом, принимающим целые значения. Собственный спиновый момент электрона характеризуется спиновым квантовым числом s, равным 1/2. Спин — фундаментальное квантовое свойство всех элементарных частиц. В соответствии со значением спинового квантового числа s частицы делятся на два класса: бозоны (целые s) и фермионы (полуцелые s). Другие значения s науке не известны. Примеры фермионов: электрон, мюон, нейтрино, кварки, частицы из трех кварков (протон, нейтрон). Примеры бозонов: фотон, недавно открытые частицы W± и Z, частицы из двух кварков (p–мезоны и др.).
Бозоны и фермионы — это не имена собственные каких-то частиц, а названия целых семейств. Бозоны и фермионы подчиняются квантовым статистикам Бозе — Эйнштейна и Ферми — Дирака соответственно, которые мы рассмотрим позднее. Каждая микрочастица принадлежит одному из этих двух семейств и поменять принадлежность уже не в состоянии. В теории элементарных частиц замечено, что из фермионов построено вещество, а бозоны являются переносчиками фундаментальных взаимодействий.

Рис. 5.24. Шатьендранат Бо́зе или Бо́шу 1894–1974

Рис. 5.25. Энри́ко Фе́рми, 1901–1954
Если собрать вместе несколько бозонов, то они не мешают друг другу занять низшее энергетическое состояние и, следовательно, все там окажутся.
Поведение коллектива фермионов регулируется принципом Паули:
|
Два одинаковых фермиона не могут находиться в одном и том же квантовом состоянии. |
В применении к атому принцип Паули запрещает двум электронам иметь одинаковый набор квантовых чисел: состояния электронов должны отличаться значением хотя бы одного из них. Если бы принципа Паули не существовало, то у всех атомов в основном состоянии все электроны находились бы на нижнем энергетическом уровне и атомы различных элементов были бы до ужаса похожи друг на друга. Таким образом, известная нам химия, все разнообразие элементов и их свойств (в частности, гамма вкусовых ощущений, отличающая, скажем, вино от сыра) — следствия принципа Паули.
До сих пор мы в основном рассматривали только атом с одним электроном. Станем добавлять лишний электрон и, соответственно, увеличивать на единицу заряд ядра. Иными словами, совершим прогулку по таблице Менделеева. Введем понятия оболочки как совокупности уровней с одинаковыми главными квантовыми числами п и подоболочки (уровни данной оболочки с одинаковыми l). Традиционные обозначения оболочек следующие
|
n = |
1 |
2 |
3 |
4 |
… |
|
символ |
K |
L |
M |
N |
… |
Число уровней в оболочке мы фактически уже подсчитали: оно равно кратности вырождения по m и l, умноженной на 2, в соответствии с двумя возможными направлениями спина электрона. Таким образом, согласно принципу Паули, оболочка может вместить 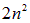 электронов, а подоболочка — 2(2l + 1) электронов (число различных значений n, удвоенное по той же причине). Итак, состояния электронов в атоме различаются квантовыми числами
электронов, а подоболочка — 2(2l + 1) электронов (число различных значений n, удвоенное по той же причине). Итак, состояния электронов в атоме различаются квантовыми числами 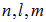 и
и  , и, по принципу Паули, лишь один электрон может иметь данный конкретный набор квантовых чисел.
, и, по принципу Паули, лишь один электрон может иметь данный конкретный набор квантовых чисел.
Напомним: три квантовых числа 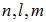 отражают трехмерность пространства,
отражают трехмерность пространства, 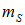 — внутренние свойства электрона.
— внутренние свойства электрона.
Порядок заполнения уровней в многоэлектронных атомах определяется энергией уровней с учетом влияния заполненных оболочек. Нижние оболочки частично экранируют заряд ядра, что ведет к некулоновскому полю для высших оболочек. Этим объясняется зависимость энергии уровней от квантового числа l. Чем больше l (для электронов одной оболочки), тем дальше находится электрон от ядра и тем слабее его связь с ядром, то есть такой уровень лежит выше. При больших моментах (состояния d, f и т. д.) энергетические уровни данной оболочки близки или даже выше s-подуровней следующей оболочки. В целом заполнение идет в таком порядке (случаются небольшие отклонения):
||1s||2s, 2p||3s, 3p||4s, 3d, 4p||5s, 4d, 5p||6s, 4f, 5d, 6p|| и т.д.
В этом ряду знаком || отделены периоды таблицы Менделеева. В соответствии с полученными формулами для числа уровней в зависимости от n и l, первый период содержит 2 элемента, второй и третий — по 8, а четвертый и пятый — по 18 элементов. Здесь «вклиниваются» заполнения d-подоболочек (по 10 элементов — переходные металлы). В шестом периоде добавляется заполнение f-подоболочки (14 элементов — лантаниды) и т. д.
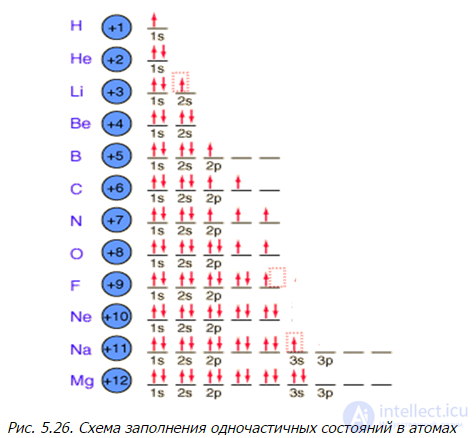
Рис. 5.26. Схема заполнения одночастичных состояний в атомах

Рис. 5.27. Современная периодическая система элементов Д.И. Менделеева
Химические свойства зависят в основном от строения внешней электронной оболочки (валентных электронов). Отсюда и вытекает периодичность повторения свойств элементов. Так, у благородных газов заполнены внешние s- и p-подоболочки из 8 электронов. У элементов первой группы (щелочные металлы) на внешней оболочке имеется всего один электрон, а галогенам (VII группа) не хватает одного электрона для заполнения внешней p-подоболочки. Все эти рассуждения хорошо знакомы по курсу химии, но они носят качественный характер. Как известно, валентность элемента определяется не столько количеством электронов, сколько степенью легкости, с которой их можно вырвать из атома. Понятно, что внешние электроны оторвать легче, но хотелось бы получить хоть какой-нибудь количественный критерий. Таким критерием может служить потенциал ионизации, пропорциональный энергии, которую необходимо затратить, чтобы удалить электрон из атома. Расчет сложных атомов непрост, но в целом таблица Менделеева объясняется квантовой механикой. Мы ограничимся лишь самыми простыми атомами и точные расчеты заменим количественными оценками. Экспериментальные результаты представлены на рис. 5.28.
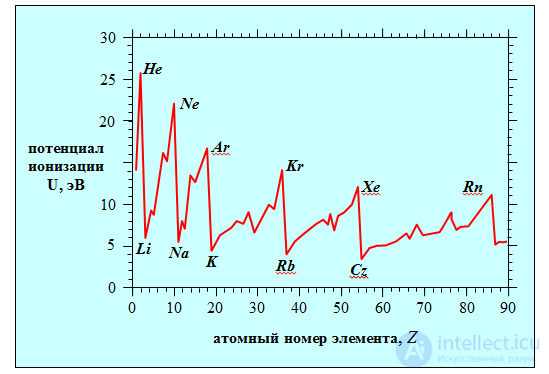
Рис. 5.28. Потенциал ионизации для элементов от водорода до урана. Ясно видна периодичность свойств элементов:
пики потенциала ионизации случаются для благородных газов, минимумы — для щелочных металлов
Эффективный заряд ядра, оценки потенциала ионизации и закон Мозли
Мы в деталях изучили энергетические уровни водородоподобных атомов, описываемые формулой Бора
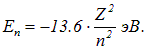
Для более сложных систем со многими электронами эта формула неверна, но мы будем ее использовать, вводя поправку на экранировку ядра электронами путем замены заряда ядра Z нa некий эффективный заряд  . Большой точности сравнения с экспериментальными данными так не добиться, но мы удовлетворимся совпадением по порядку величины.
. Большой точности сравнения с экспериментальными данными так не добиться, но мы удовлетворимся совпадением по порядку величины.
Водород. Заряд ядра Z = 1, экранировки нет, в основном состоянии n = 1. Энергия основного уровня 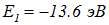 , минимальная энергия электрона, вырванного из атома, равна нулю. Следовательно, ионизационный потенциал U — это абсолютное значение энергии основного состояния, выраженное в вольтах: U = 13,6 эВ. Эта величина будет служить нам ориентиром, позволяющим не заблудиться в энергетической шкале микромира.
, минимальная энергия электрона, вырванного из атома, равна нулю. Следовательно, ионизационный потенциал U — это абсолютное значение энергии основного состояния, выраженное в вольтах: U = 13,6 эВ. Эта величина будет служить нам ориентиром, позволяющим не заблудиться в энергетической шкале микромира.
Положительный ион гелия. Ион 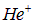 отличается от водорода только удвоенным зарядом ядра: Z = 2. Отсюда U = 13,6·4 = 54,4 эВ В.
отличается от водорода только удвоенным зарядом ядра: Z = 2. Отсюда U = 13,6·4 = 54,4 эВ В.
Гелий. Нейтральный атом гелия в основном состоянии имеет два электрона на нижней оболочке (n = 1), отличающиеся проекциями спинов. Представим себе такую картину. Когда второй электрон находится дальше от ядра, чем первый, то заряд ядра от него экранируется и равен (с его «точки зрения») единице. Когда же второй электрон располагается к ядру ближе первого, то «видимый» им заряд ядра равен двум. Оба электрона равноправны, так что описанные ситуации равновероятны.
продолжение следует...
Часть 1 5. Теория атома
Часть 2 5.4. Спин электрона и тонкая структура спектров - 5. Теория
Часть 3 5.6. Принцип Паули и валентность элементов - 5. Теория атома
Часть 4 - 5. Теория атома
Комментарии
Оставить комментарий
Базовая физика
Термины: Базовая физика