Лекция
Привет, Вы узнаете о том , что такое второе начало термодинамики энтропия, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое второе начало термодинамики энтропия , настоятельно рекомендую прочитать все из категории Синергетика.
Обратим внимание на исключительно важное обстоятельство, а именно, на роль холодильника. В каждом двигателе должен быть свой холодильник, причем на определенной стадии цикла этому холодильнику необходимо отдавать часть энергии. В этом, по существу, и состоит второе начало термодинамики. Иными словами, существует, по видимому, своего рода фундаментальный "налог": природа признает эквивалентность теплоты и работы, но требует с нас "контрибуции" всякий раз, когда теплота преобразуется в работу. Но при этом имеет место еще и асимметрия: природа не облагает "налогом" преобразования работы в теплоту, например, за счет трения.
Второе начало термодинамики имеет различные формулировки, например,
Карно: "Наибольший КПД теплового двигателя не зависит от рабочего тела и определяется только температурой, в пределах которой двигатель работает".
Клаузиус: "Теплота не может переходить от холодного тела к теплому сама собой, даровым способом".
Обратим внимание на распространенные явления природы и жизни с позиции второго начала термодинамики.
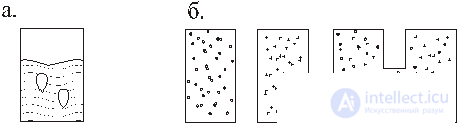
На рис. 1,а изображен сосуд с коктейлем 1 с температурой Т1и лед 2 с температурой Т2, лед растает, и установится средняя температура Т1>Тср>Т2.
На рис. 1,б в двух сосудах находятся разные газы, при соединении сосудов распределение газа устанавливается в них равномерное и одинаковое. Если в луже находится капля бензина, то она со временем растекается по поверхности. К этому же классу относятся и такие наблюдения: колечко сигаретного дыма тает; огонь костра гаснет и т. д.
Из этих наблюдений следует, что в природе господствует тенденция к рассеянию энергии, выравниванию температур, концентраций, давлений. При этом состояние вещества меняется в единственном направлении - выравнивания различных градиентов.
Отсюда возникла идея тепловой смерти Вселенной. Как писал астроном Джинс: "Не остается ничего, кроме скучного единообразия, от которого можно ожидать только небольших и незначительных местных изменений".
Состояние однообразия является как бы наиболее вероятным, что позволило дать еще одну формулировку второму началу
Больцман: "Природа стремиться к переходу от состояний менее вероятных к состояниям более вероятным".
Оказалось, что эти процессы можно выразить количественно. Для характеристики теплового состояния системы Клаузиус ввел в 1865 году новую величину - энтропию*. По гречески слово 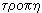 означает "обращение", "поворот", а энтропия -
означает "обращение", "поворот", а энтропия -  - "превращать", "круговорот".
- "превращать", "круговорот".
Подробнее количественное определение, вывод энтропии дан отдельным параграфом.
Энтропия - параметр, определяющий состояние системы, в частности, газа, и является функцией этого состояния, также как и давление P, объем V, температура Т, внутренняя энергия U, т. Об этом говорит сайт https://intellect.icu . е. параметр макроскопический.
Далее будет показано, что энтропия определяет состояние системы с позиции ее внутренней упорядоченности: чем больше хаос в системе, тем выше ее энтропия. Обобщая эти свойства Клаузиус сформулировал закон: "Энергия Вселенной постоянна, энтропия Вселенной стремится к максимуму".
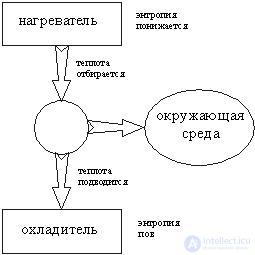
На рис. 2 представлена схема работы преобразования тепловой энергии в работу: от нагревателя передается тепловая энергия в машину, которая превращает ее в работу. При этом природе платится "налог" в виде теплоты, сообщенной холодильнику. Эта энергия уже непригодна для совершения работы, если не воспользоваться еще более "холодным" холодильником. Энергия, запасенная при более высокой температуре, обладает как бы более высоким "качеством": она пригодна для совершения работы. Посмотрим на эти процессы с позиции изменения энтропии.
Когда энергия Q1 передается от нагревателя к холодильнику, энтропия убывает на величину Q1/T1и одновременно возрастает на величину Q2/T2. Энтропия характеризует условия, при которых запасается энергия: если энергия запасается при высокой температуре T1, то ее энтропия низка и качественно высока.
Естественное течение процессов изменения характеризуется понижением качества энергии Вселенной. Поскольку энергия Вселенной остается постоянной (первое начало термодинамики), то при сжигании топлива (уголь, нефть, уран и т. д.) общие запасы энергии не меняются, но увеличивается энтропия мира. Иными словами, необходимо направить развитие цивилизации по пути снижения уровня производства энтропии.

Второе начало термодинамики говорит лишь о направлении изменения величин: энтропия растет. Рассмотрим следующий пример: приведены в соприкосновение два тела с температурами T1 и, T2 переносится поток тепла от первого ко второму телу. Такой процесс осуществляется при таянии льда в сосуде с водой (рис. 3). При этом вода отдает льду энергию 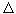 Q и ее энтропия
Q и ее энтропия 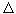 Sв падает на
Sв падает на 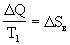 <0. Лед получает энергию
<0. Лед получает энергию 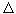 Q и его энтропия
Q и его энтропия 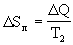 >0 возрастает. Общее изменение энтропии:
>0 возрастает. Общее изменение энтропии:
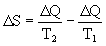 >0
>0Этот процесс необратимый, и в системе вода- лед энтропия возрастает. Возникает вопрос: до какого значения может расти энтропия? Ответ очевиден - до S=Smax, при котором возникает равновесное состояние.
Если эти выводы распространить на Вселенную, то ее ожидает полное выравнивание градиентов всех параметров в природе, т. е. тепловая смерть.
Во всей ньютоновской физике до XIX века имели дело лишь с обратимыми процессами. Действительно, второй закон механики можно представить в форме
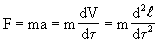
где время фигурирует в квадрате, т. е. возможно обратить процесс в прошлое (-t). Но если учесть превращение части механической энергии в теплоту из-за трения, то сила трения Fтр, как известно, пропорциональна нормальной составляющей градиента скорости, т. е.
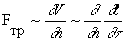
В этом случае замена положительного направления времени t на обратное (-t) приведет к изменению результатов. При учете рассеяния энергии исчезает инвариантность по отношению ко времени, т. е. процесс примет асимметричный характер.

Это проявляется во всех тепловых процессах. Например, на рис. 4,а изображен процесс выравнивания температур двух приведенных в соприкосновение тел с первоначальными температурами Т1=100o и Т2=20o Но обратный процесс (рис. 4,б) является запрещенным.
Так классическая физика споткнулась о "камень" энтропии. Этот конфликт попытался разрешить австрийский физик Больцман. Он рассматривал газ как ансамбль огромного числа движущихся молекул. Беспорядочное движение молекул в газе есть тепловое движение. Чем выше скорость молекул, тем выше температура газа, которую можно выразить через статистически усредненные скорости. Это можно сделать и для энтропии.
Так Больцману удалось получить для энтропии строгую интерпретацию в терминах ньютоновской физики. При этом Больцман дал физическое объяснение понятию "рост энтропии": рост энтропии - рост хаоса - разрушение порядка. Но об этой работе речь будет идти ниже.
Сопоставим два важнейших параметра в физике - энтропию и энергию. В гигантской фабрике естественных процессов принцип энтропии можно сравнить с ролью директора, который предписывает заключение сделок, а закон сохранения энергии играет роль главного бухгалтера, который приводит в равновесие дебет и кредит. В изолированной системе процессы идут так, что 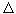 S>0.
S>0.
Обратим внимание еще на одну особенность энтропии: в обратимых процессах энтропия подобно энергии сохраняется, а в необратимых - энергия сохраняется, а энтропия растет до тех пор, пока не возникнет равновесное состояние. Если развитие естественных процессов характеризовать ростом энтропии, то и движение времени (так называемая "стрела времени") должна быть также направлена от прошлого к будущему.
В предыдущих рассуждениях неявно принималось, что обратимый процесс протекает бесконечно медленно, т. к. на каждом этапе, хотя бы при анализе цикла Карно, существует равновесие. Температура газа Тг равна температуре Тх холодильника, Тг=Тх. В рассуждениях отсутствует понятие скорости процесса, времени. Эта особенность рассмотрения процессов позволяет назвать классическую термодинамику правильнее термостатикой. В дальнейшем в рассуждения будет введено время, и этим будет сделан первый шаг к подлинной термодинамике.
Прочтение данной статьи про второе начало термодинамики энтропия позволяет сделать вывод о значимости данной информации для обеспечения качества и оптимальности процессов. Надеюсь, что теперь ты понял что такое второе начало термодинамики энтропия и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Синергетика
Из статьи мы узнали кратко, но содержательно про второе начало термодинамики энтропия
Комментарии
Оставить комментарий
Синергетика
Термины: Синергетика