Лекция
Привет, Вы узнаете о том , что такое термодинамика открытых систем, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое термодинамика открытых систем, открытая система , настоятельно рекомендую прочитать все из категории Синергетика.
Термодинамическая система — физическое тело (совокупность тел), способное (способных) обмениваться с другими телами (между собой) энергией и (или) веществом ; выделяемая (реально или мысленно) для изучения макроскопическая физическая система, состоящая из большого числа частиц и не требующая для своего описания привлечения микроскопических характеристик отдельных частиц , «часть Вселенной, которую мы выделяем для исследования» . Единицей измерения числа частиц в термодинамической системе обычно служит число Авогадро (примерно 6·1023 частиц на моль вещества), дающее представление, о величинах какого порядка идет речь. Ограничения на природу материальных частиц, образующих термодинамическую систему, не накладываются: это могут быть атомы, молекулы, электроны, ионы, фотоны и т. д.
открытая система в теории систем — система, которая непрерывно взаимодействует со своей средой. Взаимодействие может принимать форму информации, энергии или материальных преобразований на границе с системой. Открытая система противопоставляется изолированной, которая не обменивается энергией, веществом или информацией с окружающей средой.
Понятие открытой системы было формализовано[кем?], что позволило взаимосвязать теорию организмов, термодинамику и эволюционную теорию . Это понятие подробно анализировалось с появлением теории информации и впоследствии теории систем. Сейчас у понятия есть применения в естественных и общественных науках.
Применим закономерности термодинамики открытых систем к живым организмам. Для этого живой организм (открытая система) вместе с ее окружением отделим от остального мира адиабатической оболочкой. Об этом говорит сайт https://intellect.icu . Тогда к такой системе возможно применить законы термодинамики.
Рассмотрим три примера из этой области -
космонавт в кабине космического корабля,
деление живой клетки и
человек в парилке.
Рисунок 1. Некоторые результаты полезной работы (∆G) в живых биологических системах. А. - светлячок излучает свет для привлечения полового партнера; Б. - электрический угорь убивает врагов-хищников электрическим разрядом; В. - почки животных концентрируют растворенные вещества против градиента концентрации; Г. - сила мышечнолго сокращения предвигает тяжелый груз.
Рисунок 1. Некоторые результаты полезной работы (∆G) в живых биологических системах. А. - светлячок излучает свет для привлечения полового партнера; Б. - электрический угорь убивает врагов-хищников электрическим разрядом; В. - почки животных концентрируют растворенные вещества против градиента концентрации; Г. - сила мышечнолго сокращения предвигает тяжелый груз.

Внутренность кабины изолирована от окружающего пространства. Космонавт - открытая система, изменение его энтропии dS(к) равно
dS(к) = diS(к) + dеS,
где diS(к) - производство энтропии космонавтом, deS - поток энтропии из-за обмена теплом и веществом космонавта с окружающей средой.
Изменение энтропии dS(с) среды вокруг космонавта равно
dS(с) = - dеS,
и общее изменение энтропии
dS = dS(к) + dS(с) = diS(к) > 0,
т. к. энтропия dS изолированной системы возрастает на величину производства энтропии космонавта diS(к).
Если космонавт молод и здоров, то его состояние стационарно и его энтропия не меняется, т.е.
dS(к) = diS(к) + dеS = 0.
В стационарном состоянии производство энтропии внутри системы diS(к) > 0, компенсируется ее оттоком наружу dеS < 0.
Можно специально показать, что отток dеS энтропии выше, чем энтропия веществ, потребляемых в пище; количество энергии в стационарном состоянии не меняется.
Известный физик Шредингер в 1949 г. поставил следующий вопрос "что же тогда составляет то драгоценное НЕЧТО, содержащееся в нашей пище, что предохраняет нас от смерти?" Живой организм увеличивает энтропию S Smax и приближает его к смерти. Уйти от этого состояния можно при большом оттоке энтропии в среду или, иначе выражаясь, из-за извлечения из среды отрицательной энтропии; последняя носит название "негэнтропии". Отрицательная энтропия и есть то драгоценное НЕЧТО, чем питается организм. В метаболизме существенно освобождение организма от произведенной им энтропии.
Smax и приближает его к смерти. Уйти от этого состояния можно при большом оттоке энтропии в среду или, иначе выражаясь, из-за извлечения из среды отрицательной энтропии; последняя носит название "негэнтропии". Отрицательная энтропия и есть то драгоценное НЕЧТО, чем питается организм. В метаболизме существенно освобождение организма от произведенной им энтропии.
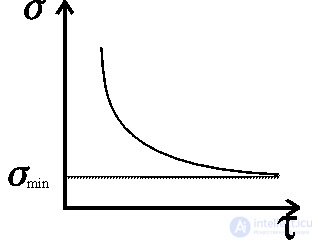
Рис.1.Зависимость функции диссипации от времени.
Пригожин показал, что если стационарное состояние открытой системы близко к равновесному, то функция диссипации имеет минимум, т. е. по мере приближения к стационарному состоянию она убывает d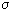 /d
/d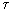 <0, а в стационарном состоянии d
<0, а в стационарном состоянии d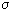 /d
/d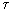 =0 (рис. 3.3). Иными словами, рост молодого организма (мощный метаболизм, повышенный обмен веществ) в приведенных терминах запишется
=0 (рис. 3.3). Иными словами, рост молодого организма (мощный метаболизм, повышенный обмен веществ) в приведенных терминах запишется
dS(к) = diS(к) + deS < 0,
а старение, напротив, сопровождается возрастанием энтропии, нет ее компенсации из-за оттока наружу
dS(к) = diS(к) + deS > 0,
и смерть наступает при S = Smax .
Клетка - открытая система и ее баланс энтропии выражается соотношением
dS = diS + deS.
Представим клетку в виде шара радиусом r, производство энтропии diS пропорционально объему  , а отток deS пропорционален площади поверхности 4
, а отток deS пропорционален площади поверхности 4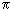 r2. Следовательно, изменение энтропии dS равно
r2. Следовательно, изменение энтропии dS равно
dS=А - В4
- В4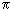 r2,
r2,
где А и В - коэффициенты.
Нетрудно видеть, что при r = 3В/А, dS = 0. При меньших r < 3В/А отток энтропии выше ее производства. Когда r > 3В/А, dS > 0 и в клетке накапливаются вещества с избыточной энтропией и клетка перегревается. Поэтому при r = 3В/А клетка должна разделиться, иначе она погибнет, причем в новых двух клетках объем не изменится, а поверхность возрастет. Радиусы r1 новых клеток нетрудно найти
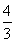 = 2
= 2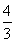
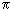 r13 , r3=2r13, r1= r /
r13 , r3=2r13, r1= r / .
.
Изменение энтропии в двух новых клетках равно dS = 2 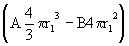 . При r = 3В/А = r1
. При r = 3В/А = r1 или r1 =
или r1 = 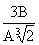 получаем dS = 36
получаем dS = 36
 <0, т. е. отток энтропии увеличился в
<0, т. е. отток энтропии увеличился в 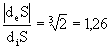 раз.
раз.
Итак, деление клеток связано с оттоком энтропии, это неравновесные процессы, а рост кристалла возникает при равенстве свободных энергий и расплава; здесь имеет место равновесный фазовый переход.
Рассмотрим поведение организма человека, когда он находится в парилке.
Определим производство энтропии diS человека в любых условиях. Заметим, что экспериментально установлено на основании прямой калометрии (изменение потерь человека в калориметре), а также с помощью непрямой калометрии (на основе газового обмена при дыхании человека), что человек в условиях комфорта вырабатывает мощность 100 Вт. Кстати, данные прямой и непрямой калометрии при длительном проведении опыта в среднем совпадают. Будем полагать, что человек пребывает в парилке 2 часа или 7 200 секунд, за это время он "выработает" энергию Q=100Вт*7200с=7,2*105Дж, температуру тела человека примем 36°С или примерно 300°К, т. е. производство энтропии равно
diS=7,2*105 /3*102=2,4*103Дж/К.
Предположим, что в процессе парения человек потерял в весе массу m=2 кг, т. е. за 2 часа испарил 2 кг воды. Теплота испарения воды (H = 4*104 Дж/моль), молекулярный вес воды - M(H20) = 18 г/моль, потеря энергии dQ = m*H*M = 2*4*104*18 = 12,8* 105 Дж.
Найдем поток энтропии deS = dQ / T =12,8*105 / 3*102 = 4,2*103 Дж/К.
Сопоставим производство энтропии diS и отток энтропии deS
diS=2,4*103 Дж.К, deS=4,2*103 Дж/К.
В рассматриваемом случае имеем дело с энтропийным насосом, при действии которого происходит отток энтропии из системы, что должно приводить отдельные органы человека в более организованное состояние и, если этот процесс проводить в умеренных рамках, то общее состояние человека после бани должно улучшаться.
Прочтение данной статьи про термодинамика открытых систем позволяет сделать вывод о значимости данной информации для обеспечения качества и оптимальности процессов. Надеюсь, что теперь ты понял что такое термодинамика открытых систем, открытая система и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Синергетика
Комментарии
Оставить комментарий
Синергетика
Термины: Синергетика