Лекция
Это окончание невероятной информации про депрессия.
...
данной фармакологической группы повышают уровни мозгового нейротрофического фактора.
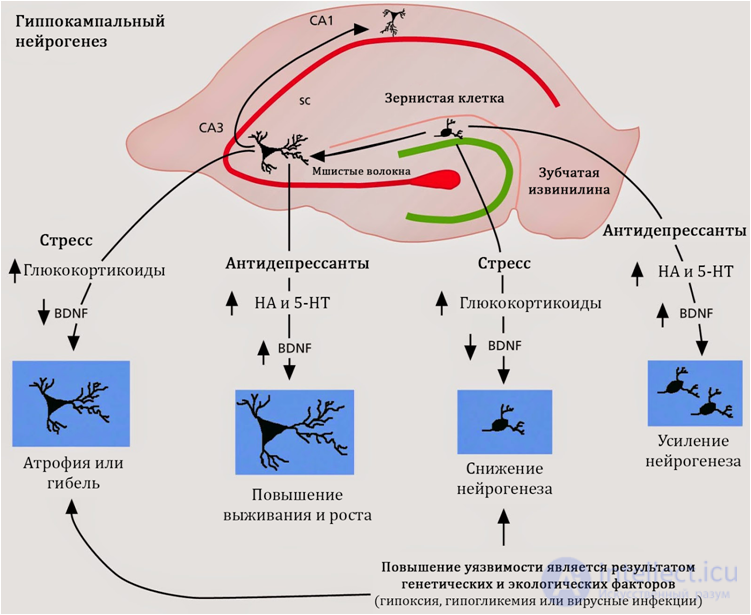 Рис. 19
Рис. 19
Стимуляция нейрогенеза характерна для антидепрессантов независимо от их механизма действия, химического строения или класса. Следовательно, поиск механизмов регуляции нейрогенеза следует осуществлять в общих для всех антидепрессантов свойствах. Таким общими свойствами является активность антидепрессантов в отношении серотонина и норадреналина.
На сегодняшний день формируется представление о роли серотонина в регуляции гиппокампального нейрогенеза.
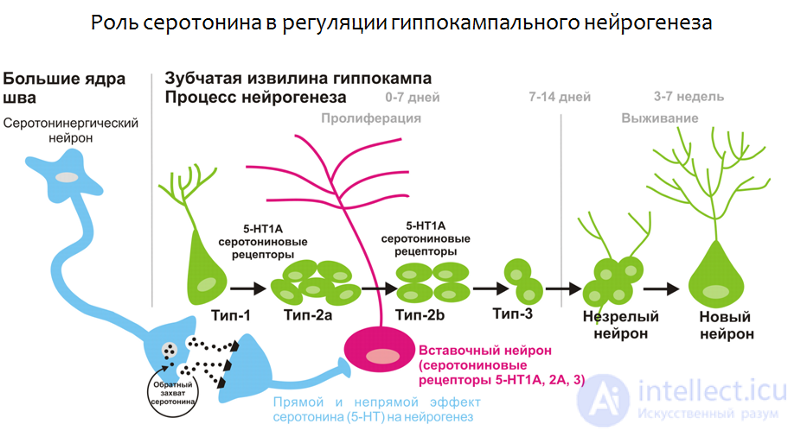 Рис. 20. Alenina N., Klempin F. The role of serotonin in adult hippocampal neurogenesis. Behavioural Brain Research. 2015. 277. P. 49–57.
Рис. 20. Alenina N., Klempin F. The role of serotonin in adult hippocampal neurogenesis. Behavioural Brain Research. 2015. 277. P. 49–57.
Во-первых, зубчатая извилина гиппокампа получает серотониновую регуляцию от больших ядер шва (скопление нервных клеток, которые вырабатывают серотонин; располагаются в стволе мозга) как напрямую, так и через вставочные нейроны, которые несут на своей поверхности различные подтипы серотониновых рецепторов.
Во-вторых, на самих стволовых клетках обнаружены серотониновые рецепторы 1А подтипа, что говорит о потенциальной возможности серотонина регулировать стволовые клетки мозга.
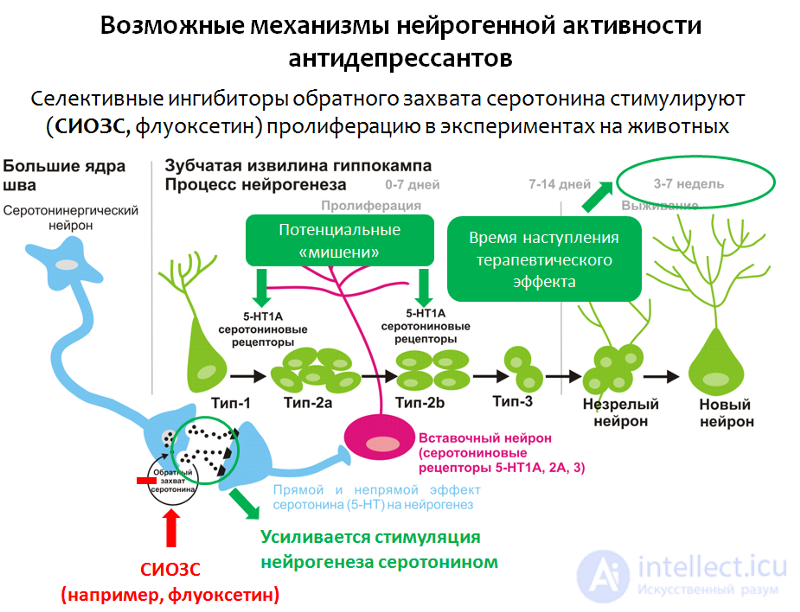 Рис. 21
Рис. 21
Как было показано в экспериментальных исследованиях (на животных и культурах клеток), селективные ингибиторы обратного захвата серотонина (СИОЗС, классический препарат из этой группы — флуоксетин) способны стимулировать стадию пролиферации нейрогенеза в гиппокампе.
Предполагаемый механизм — повышение концентрации серотонина (5-НТ — серотонин, он же 5-гидрокситриптамин) в ЦНС и последующая (усиленная) стимуляция серотонином нейрогенеза.
Потенциальными мишенями антидепрессантов в процессе нейрогенеза также могут служить серотониновые рецепторы 1А подтипа (5НТ1А-рецепторы). Эти предположения согласуются с данными о положительном (терапетивческом) эффекте активации серотониновых 5-НТ1А-рецепторов антидепрессантами (например, вилазодоном) на фоне депрессивных расстройств.
Еще одним аргументом, который позволяет рассматривать стимуляцию нейрогенеза как основной механизм действия антидепрессантов, является совпадение во времени между средним временем наступления терапевтического эффекта (от 2 до 7 недель) и полным циклом нейрогенеза (3–7 недель).
Помимо перечисленных механизмов, антидепрессанты из группы СИОЗС также демонстрируют способность повышать уровни BDNF, однако механизмы этого эффекта остаются неизвестными.
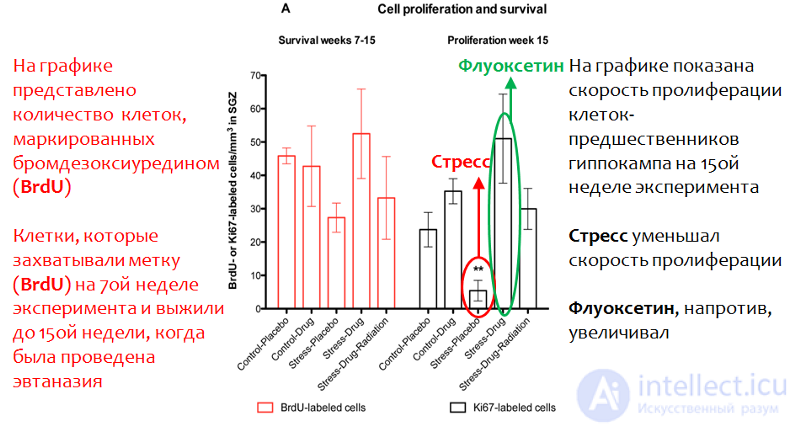 Рис. 22. Perera T.D., Dwork A.J., Keegan K.A., et al. Necessity of Hippocampal Neurogenesis for the Therapeutic Action of Antidepressants in Adult Nonhuman Primates // PLoS ONE. 2011. 6(4):e17600. doi:10.1371/journal.pone.0017600.
Рис. 22. Perera T.D., Dwork A.J., Keegan K.A., et al. Necessity of Hippocampal Neurogenesis for the Therapeutic Action of Antidepressants in Adult Nonhuman Primates // PLoS ONE. 2011. 6(4):e17600. doi:10.1371/journal.pone.0017600.
В исследованиях на приматах (наиболее релевантная животная модель) показана способность флуоксетина (торг. название «прозак») стимулировать нейрогенез на фоне стресса (в данном случае была использована модель изоляционного стресса). На рисунке 22 показано, что флуоксетин значительно увеличивал (статистически достоверно) скорость пролиферации (деления) стволовых нервных клеток в гиппокампе приматов.
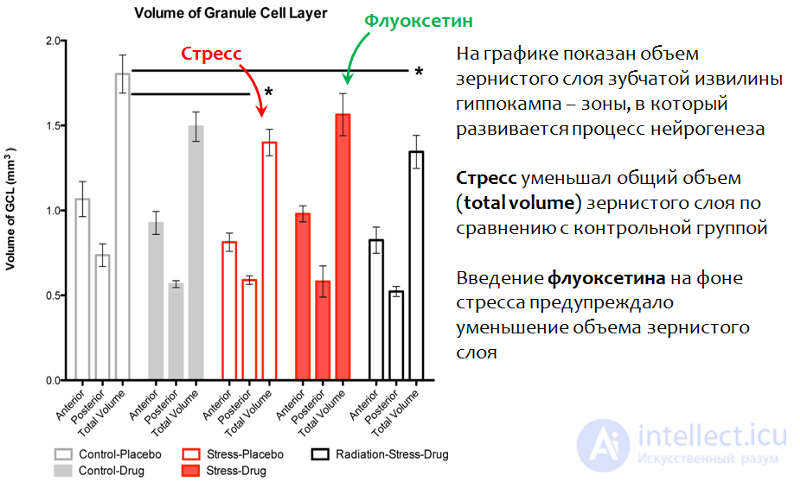 Рис. 23. Perera T.D., Dwork A.J., Keegan K.A., et al. Necessity of Hippocampal Neurogenesis for the Therapeutic Action of Antidepressants in Adult Nonhuman Primates // PLoS ONE. 2011. 6(4):e17600. doi:10.1371/journal.pone.0017600.
Рис. 23. Perera T.D., Dwork A.J., Keegan K.A., et al. Necessity of Hippocampal Neurogenesis for the Therapeutic Action of Antidepressants in Adult Nonhuman Primates // PLoS ONE. 2011. 6(4):e17600. doi:10.1371/journal.pone.0017600.
Воздействие стресса приводило к уменьшению зернистого слоя зубчатой извилины гиппокампа — основной нейрогенной зоны мозга приматов. Введение флуоксетина на фоне стрессовой экспозиции предупреждало это изменение и сохраняло нормальной объем этой структуры (общий объем).
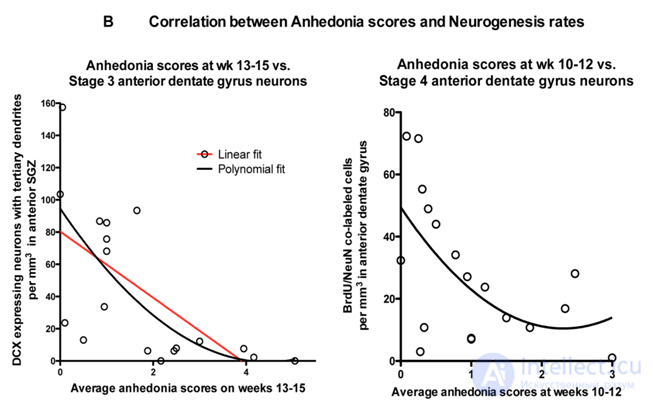 Perera T.D., Dwork A.J., Keegan K.A., et al. Necessity of Hippocampal Neurogenesis for the Therapeutic Action of Antidepressants in Adult Nonhuman Primates. PLoS ONE. 2011. 6(4):e17600. doi:10.1371/journal.pone.0017600.
Perera T.D., Dwork A.J., Keegan K.A., et al. Necessity of Hippocampal Neurogenesis for the Therapeutic Action of Antidepressants in Adult Nonhuman Primates. PLoS ONE. 2011. 6(4):e17600. doi:10.1371/journal.pone.0017600.
Было установлено наличие корреляции между стимуляцией нейрогенеза флуоксетином и предупреждением развития депрессивного поведения (ангедонии).
При изучении влияния флуокситина на нейрогенез нечеловекоподобных приматов была установлена достоверная корреляция между снижением нейрогенеза (вызванного стрессом) и усилением депрессивно-подобного поведения приматов (ангедония, которую определяли по совокупности нарушений социального и пищевого поведения), а также корреляция между стимуляцией нейрогенеза флуоксетином и отсутствием депрессивно-подобного поведения.
Норадреналин — другой важный моноамин, который наравне с серотонином способен принимать участие в регуляции гиппокампального нейрогенеза.
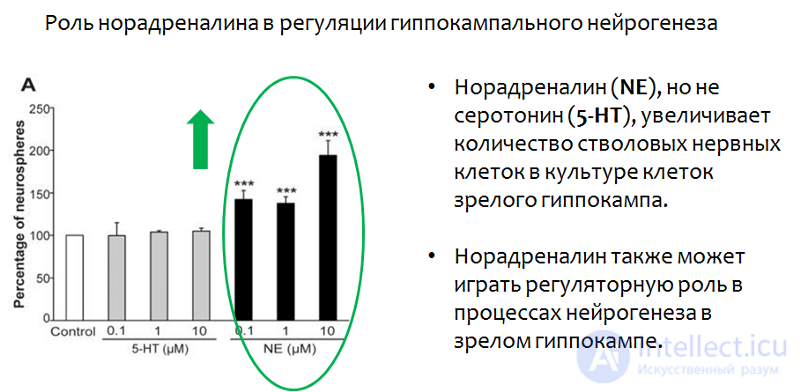 Рис.25. Jhaveri D.J., Mackay E.W., Hamlin A.S., et al. Norepinephrine directly activates adult hippocampal precursors via β3 adrenergic receptors // The Journal of Neuroscience. 2010. 30(7). З. 2795–2806. doi:10.1523/JNEUROSCI.3780–09.2010.
Рис.25. Jhaveri D.J., Mackay E.W., Hamlin A.S., et al. Norepinephrine directly activates adult hippocampal precursors via β3 adrenergic receptors // The Journal of Neuroscience. 2010. 30(7). З. 2795–2806. doi:10.1523/JNEUROSCI.3780–09.2010.
В исследованиях на культурах нейронов гиппокампа было показано, что норадреналин, (в отличие от серотонина) повышал количество стволовых клеток. Серотонин же, как было продемонстрировано ранее, влиял не на количество, а на скорость пролиферации.
Помимо количественных изменений норадреналин вызывал и качественные — увеличивал размеры нейросфер, что наглядно показано на снимке электронного микроскопа (см. рис.26).
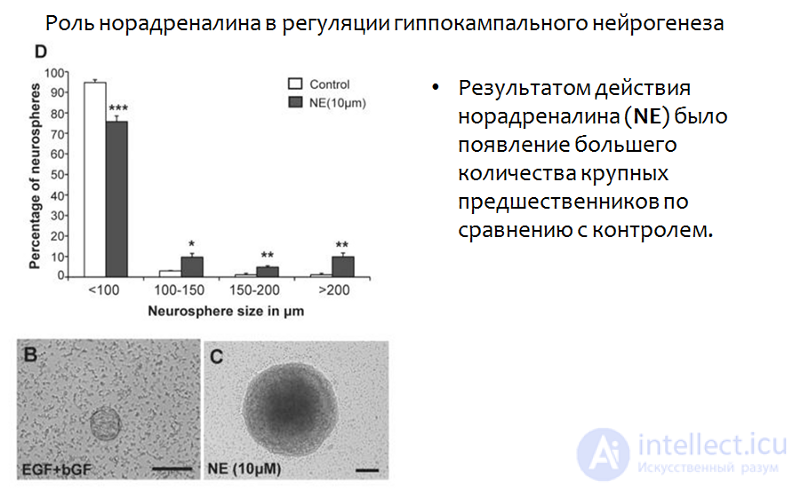 Рис. 26. Jhaveri D.J., Mackay E.W., Hamlin A.S., et al. Norepinephrine directly activates adult hippocampal precursors via β3 adrenergic receptors // The Journal of Neuroscience. 2010. 30(7). З. 2795–2806. doi:10.1523/JNEUROSCI.3780–09.2010.
Рис. 26. Jhaveri D.J., Mackay E.W., Hamlin A.S., et al. Norepinephrine directly activates adult hippocampal precursors via β3 adrenergic receptors // The Journal of Neuroscience. 2010. 30(7). З. 2795–2806. doi:10.1523/JNEUROSCI.3780–09.2010.
Ранее нами были рассмотрены изменения в нейронах, но проигнорирована роль глиальных клеток в формировании депрессивных расстройств. Тем не менее, экспериментальные и клинические исследования указывают на возможную роль патологии глиальных клеток в патогенезе депрессии.
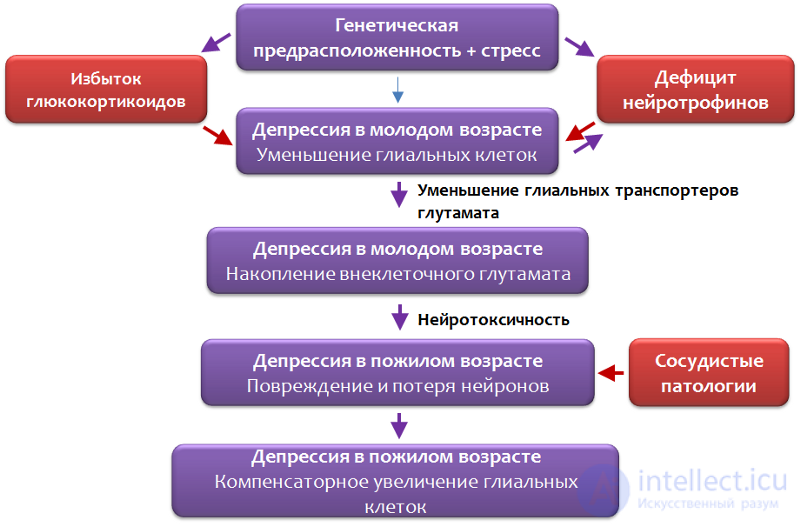 Рис. 27. Rajkowska G., Miguel-Hidalgo J. J. Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007. 6(3). P. 219–233.
Рис. 27. Rajkowska G., Miguel-Hidalgo J. J. Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007. 6(3). P. 219–233.
Исследователями была представлена схема патогенеза депрессивных расстройств при участии глии (Рис. 27).
Генетическая предрасположенность может включать: наследственный фактор (наличие депрессивного расстройства у одного из родителей повышает риск этого заболевания у ребенка); полиморфизм генов: BDNF, серотонинового переносчика (который участвуют в обратном захвате серотонина в нервные и глиальные клетки), серотониновых рецепторов, ферментов синтеза серотонина (триптофан гидроксилазы 2 типа).
Генетическая уязвимость в совокупности с экологическими и стрессовыми факторами создает благоприятную среду для формирования депрессивного расстройства.
Учеными было установлено, что роль глиальных клеток неодинакова у молодых и пожилых больных (Рис. 28). Глиальные клетки могут играть важную роль в патогенезе ранних стадий депрессивных расстройств, которые могут обуславливать выраженное уменьшение количества пирамидных нейронов в более зрелом возрасте.
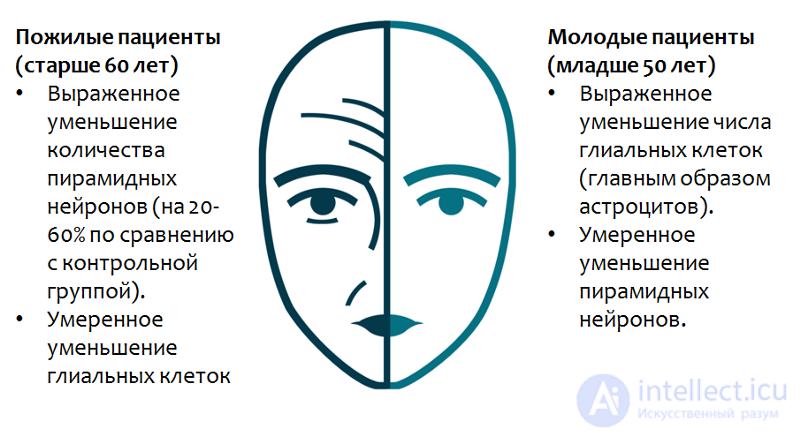 Рис. 28. Rajkowska G., Miguel-Hidalgo J. J. Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007. 6(3). P. 219–233.
Рис. 28. Rajkowska G., Miguel-Hidalgo J. J. Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007. 6(3). P. 219–233.
В частности, потеря функции глиальных клеток в молодом возрасте повышает риск развития повторных эпизодов депрессии в пожилом возрасте, но при этом будет преобладать уже дефицит пирамидных нейронов, а не глиальных клеток.
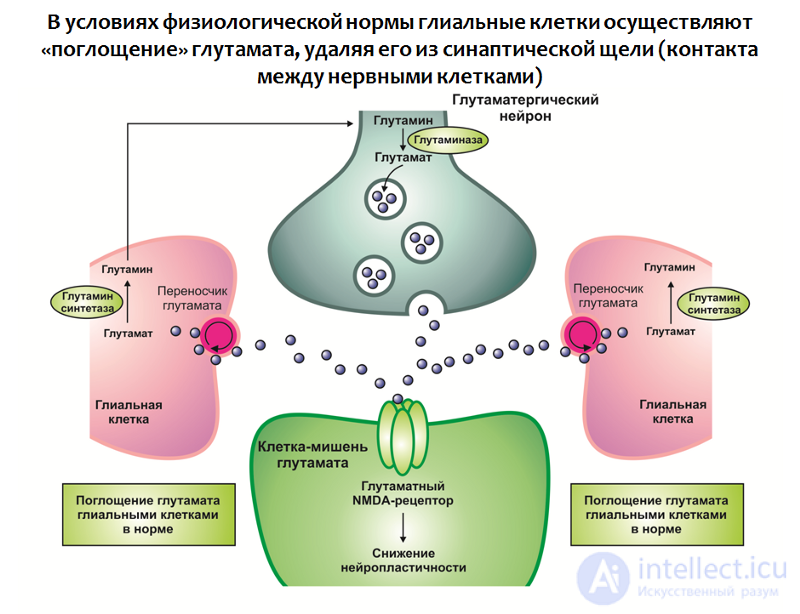 Рис. 29. Rajkowska G., Miguel-Hidalgo J. J. Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007. 6(3). P. 219–233.
Рис. 29. Rajkowska G., Miguel-Hidalgo J. J. Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007. 6(3). P. 219–233.
Подобная динамика согласуется с одной из важнейших функций глиальных клеток — поглощением избытка глутамата из синаптической щели (контакта между нервными клетками). Глутамат является одним из основных возбуждающих нейромедиаторов ЦНС и его чрезмерное действие может приводить к нарушению нейропластичности и эксайтотоксичности (нейротоксичность, связанная с избыточным возбуждением; по-видимому, является защитной реакцией нервных клеток от перевозбуждения — количество нейронов и связей между ними уменьшается).
В глиальных клетках находится белок-транспортер, который участвует в переносе глутамата из синаптической щели в глиальную клетку, где глутамат подвергается метаболизму.
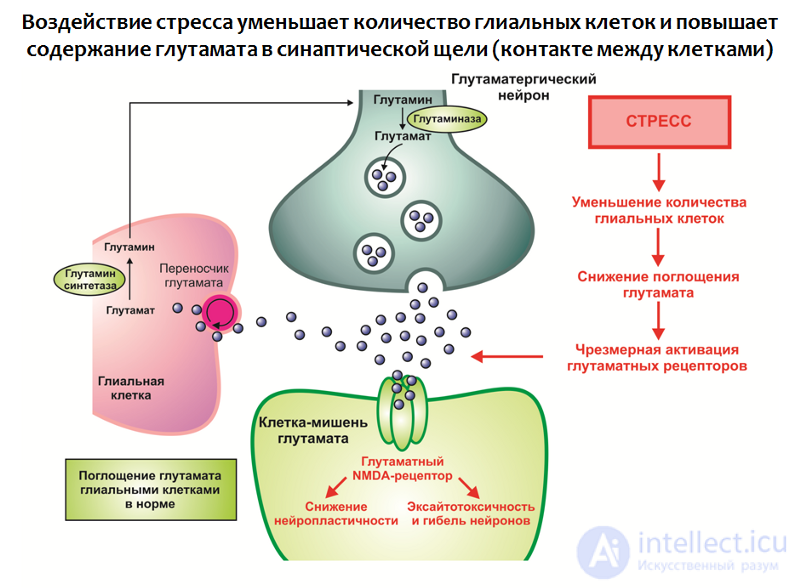 Рис. 30. Rajkowska G., Miguel-Hidalgo J. J. Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007. 6(3). P. 219–233.
Рис. 30. Rajkowska G., Miguel-Hidalgo J. J. Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007. 6(3). P. 219–233.
Воздействие стресса в совокупности с другими факторами приводит к:
Таким образом формируется избыток этого возбуждающего нейромедиатора, который является отрицательным модулятором нейропластичности (как полагают, это может быть частью компенсаторной реакции, защищающей нервную систему от перевозбуждения).
Функция глиальных клеток не ограничивается поглощением глутамата, они также участвуют в выработке нейротрофинов, в частности BDNF (рис.31).
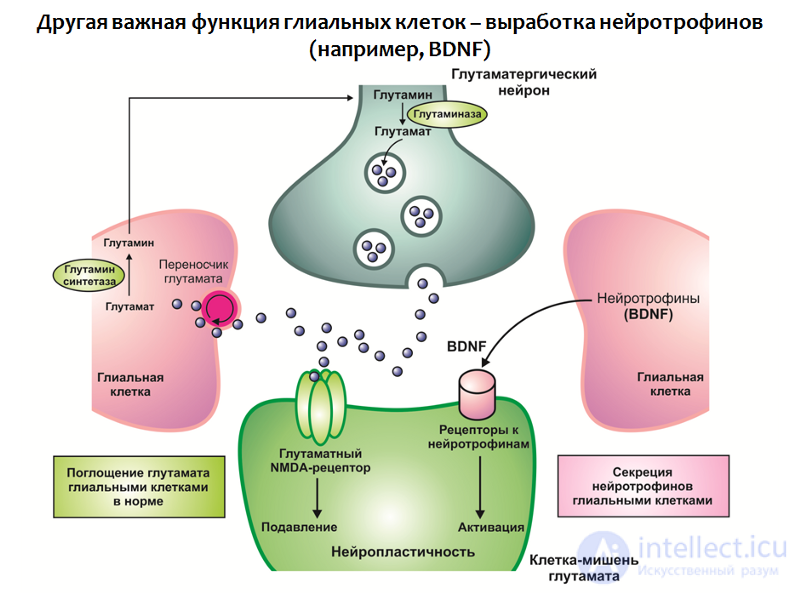 Рис. 31
Рис. 31
В совокупности дефицит нейротрофинов и избыток глутамата приводят к нарушению нейропластичности и деперссивно-подобным изменениям (уменьшению объема гиппокампа и префронтальной коры, нарушению нормальной функциональной связи между структурами лимбического круга).
В контексте данной концепции также возможно найти объяснения терапевтической эффективности антидепрессантов (Рис. 32):
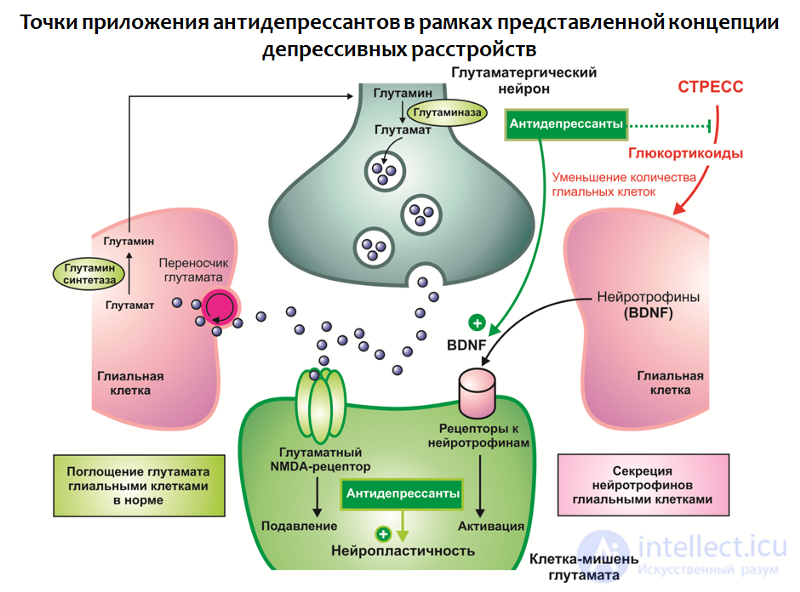 Рис. 32
Рис. 32
На рисунке 33 представлена обобщенная схема депрессивных расстройств, которая построена на концепции стресс-опосредованной нейродегенерации. Видно, что антидепрессанты занимают нишу «корректоров последствий стресса». При всех имеющихся достоинствах и терапевтическом потенциале, антидепрессанты оказываются не всегда эффективны в устранении депрессивной симптоматики.
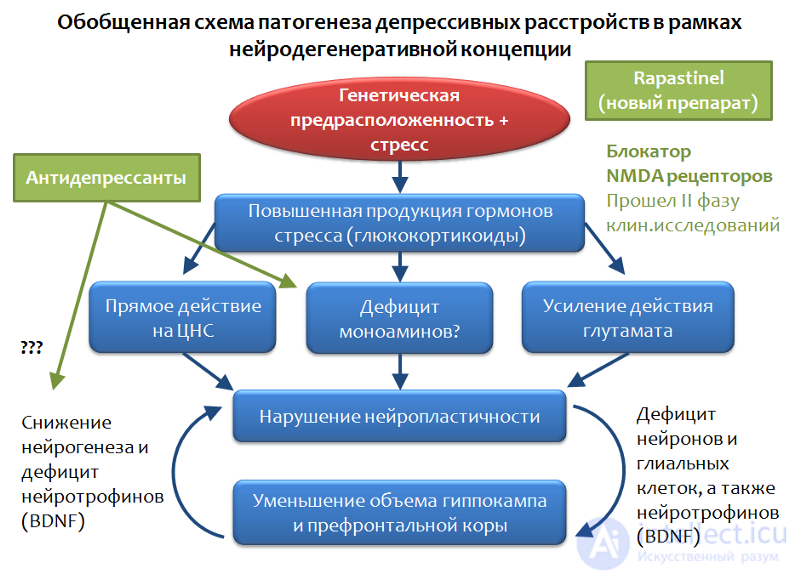 Рис. 33
Рис. 33
Существуют, так называемые, резистентные к фармакотерапии формы депрессивных расстройств. Этот феномен пытаются объяснить и разнообразностью стрессовых факторов, и различной силой и продолжительностью стрессовой экспозиции, и индивидуальными особенностями (мутация мишеней антидепрессантов). Но общий вывод из данной ситуации один — необходим поиск принципиально новых мишеней для фармакотерапии депрессивных расстройств.
Перспективным направлением представляется воздействие на систему глутамата, если рассматривать этот нейромедиатор как один из ключевых элементов патогенеза депрессивных расстройств. В рамках этого направления получены значительные успехи — создан принципиально новый антидепрессант, который по своему механизму является блокатором глутаматный NMDA-рецепторов и препятствует чрезмерной активности этой аминокислоты. Антидепрессант Rapasintel в настоящее время успешно прошел I и II фазы клинических исследований, где показал высокую эффективность и рассматривается как средство лечения устойчивых форм депрессивных расстройств.
В рамках глутаматергической теории депрессивных расстройств можно рассмотреть и роль основного тормозного медиатора ЦНС — гамма-аминомасляной кислоты (ГАМК или GABA).
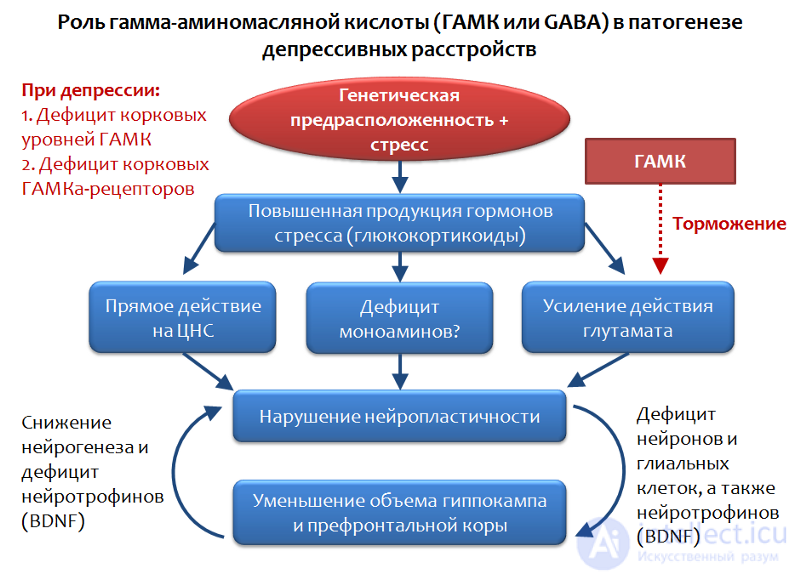 Рис. 34. Möhler H. The GABA system in anxiety and depression and its therapeutic potential // Neuropharmacology. 2012. Jan. 62(1). P. 42–53.
Рис. 34. Möhler H. The GABA system in anxiety and depression and its therapeutic potential // Neuropharmacology. 2012. Jan. 62(1). P. 42–53.
ГАМК является функциональной противоположностью глутамата и способна ограничивать его возбуждающее действие, поэтому оценка роли ГАМК в депрессивных расстройствах представляется вполне логичной.
Установлено, что на фоне депрессивных расстройств наблюдается дефицит корковых уровней ГАМК и ее рецепторов. В частности, пирамидные нейроны, вырабатывающие глутамат, могут подвергаться тормозному влиянию интернейронов, вырабатывающих ГАМК. ГАМК реализует свое тормозное действие посредством активации ГАМК-А-рецептора.
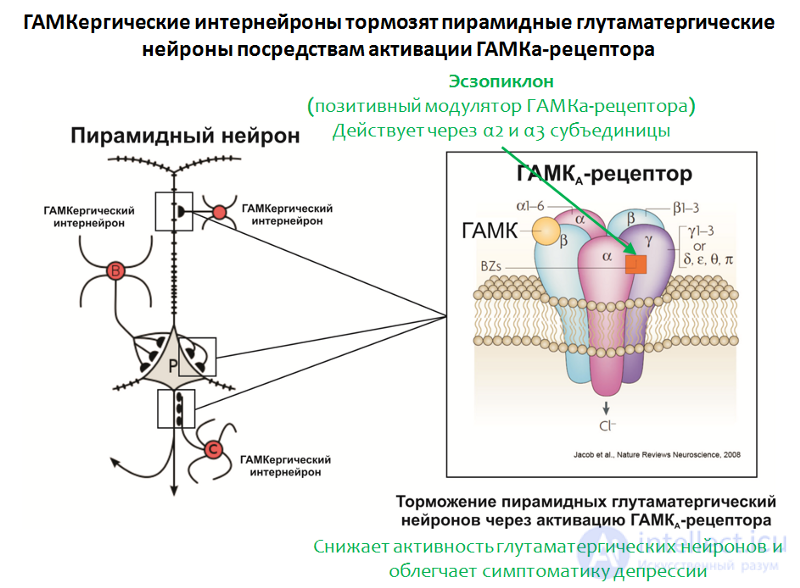 Рис. 35. Möhler H. The GABA system in anxiety and depression and its therapeutic potential // Neuropharmacology. 2012. Jan. 62(1). P. 42–53.
Рис. 35. Möhler H. The GABA system in anxiety and depression and its therapeutic potential // Neuropharmacology. 2012. Jan. 62(1). P. 42–53.
Структура ГАМК-А рецептора представлена на рисунке 35. Рецептор состоит из 5 субъединиц (2α, 2β и γ), каждая субъединица имеет подтип, например известно 6 вариантов α-субъединиц. Комбинация различных вариантов субъединиц определяет подтип ГАМК-А рецептора.
В подтверждение роли ГАМК говорит и эффективность положительного модулятора ГАМК-А рецептора — эсзопиклона. Мишенью данного препарата являются ГАМК-А рецепторы, несущие в своем составе α2– и α3-субъединицы.
Эсзопиклон
иногда применяется в комбинации с антидепрессантами и значительно облегчает депрессивную симптоматику даже после отмены антидепрессантов. Предполагают, что его терапевтическое действие связано с ослаблением функции глутамата. Интересно, что другие положительные модуляторы ГАМК-А рецептора (для которых необходимо наличие других вариантов α субъединиц, например золпидем) подобной активностью не обладают.
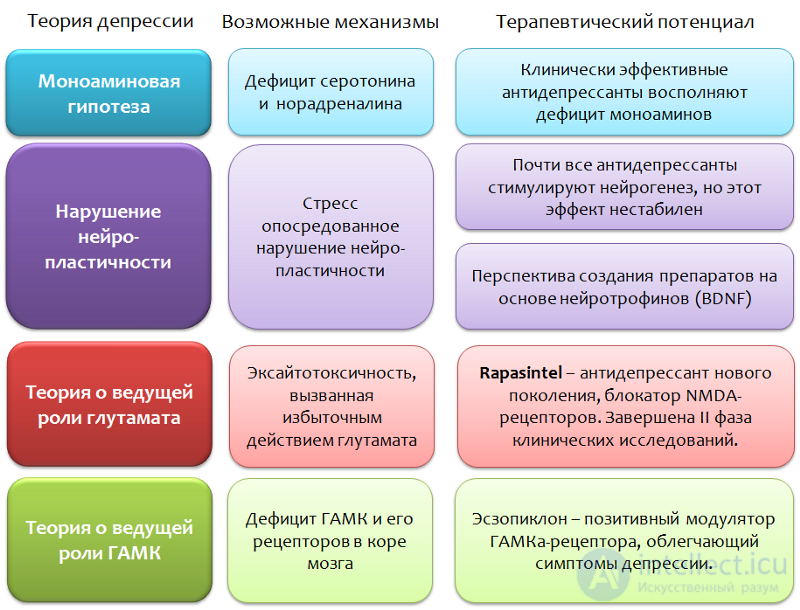 Рис. 36
Рис. 36
И так, в представленной схеме (Рис. 37) мы резюмируем данные о нарушении процессов нейропластичности и развитии депрессивной симптоматики.
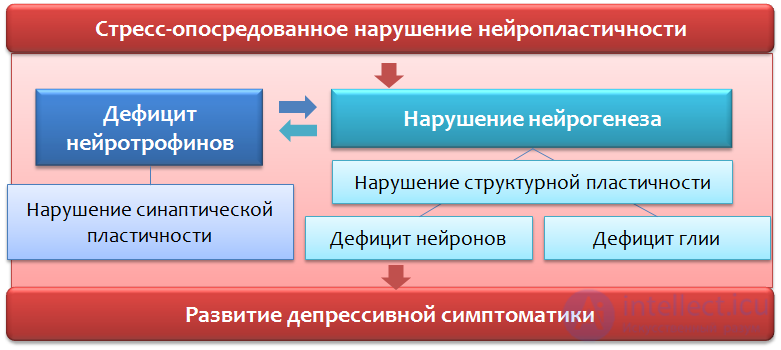 Рис. 37
Рис. 37
— Подавление процессов нейропластичности не является специфичным для депрессивных расстройств
— На животных моделях подавление пролиферации стволовых клеток не всегда блокирует эффекты антидепрессантов
— Ресурс нейрогенеза может оказаться ограниченным, и чрезмерная стимуляция может привести к истощению.
— Неизвестны долгосрочные последствия длительной «насильственной» стимуляции нейрогенеза. Существует ли риск развития опухолевого процесса?
— Нарушение нейропластичности не является исчерпывающей концепцией депрессивных расстройств.
Теории о роли нейромедиаторных аминокислот — глутамата и ГАМК, не являются исчерпывающими. Во-первых, представленные системы (глутаматергическая и ГАМКергическая) не могут быть рассмотрены изолированно от других факторов, т.к. по сути, являются промежуточным звеном патогенеза депрессивных расстройств или отдельных симптомов. Во-вторых, изменения в глутаматергической и ГАМКергической системах мозга наблюдаются не только при депрессивных, но и ряде других расстройств и состояний (шизофрения, тревожные расстройства, панические атаки, эпилепсия, болевая чувствительность, болезнь Паркинсона, болезнь Альцгеймера).
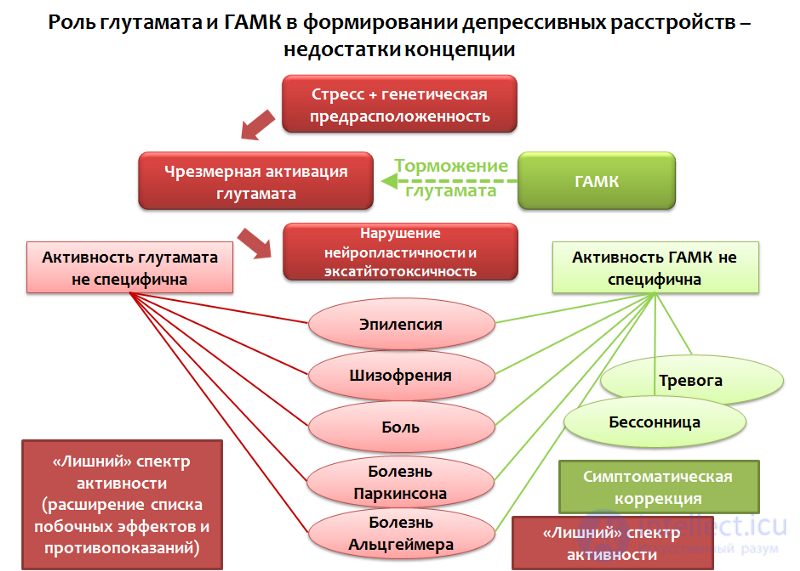 Рис. 38
Рис. 38
Если рассматривать фармакологическое вмешательство в глутаматергическую систему, то оно, несомненно, перспективно и даже инновационно, т.к. ранее все антидепрессанты действовали исключительно на моноаминегическую систему мозга. Однако, столь широкий функционал глутамата в ЦНС может привести к развитию нежелательных эффектов и ряду противопоказаний. Но рано давать прогнозы, блокатору глутаматных рецепторов еще предстоит пройти III фазу клинических исследований. Препарат рассматривается не как замена современным антидепрессантам, а как средство дополнительной терапии (например, при устойчивых формах депрессий).
Препараты, являющиеся позитивным модуляторами ГАМКа-рецепторов, в настоящее время не рассматриваются как самостоятельные антидепрессанты, они полезны в устранении отдельных симптомов депрессивных расстройств.
Перспективным направлением для разработки новых эффективных и безопасных антидепрессантов представляется изучение механизмов самого стресса, поскольку именно стрессовый фактор (стрессовые события) рассматривается в качестве основного пускового стимула для формирования депрессивных расстройств.
В основе поиска и создания «идеального» антидепрессанта должно лежать два простых принципа (согласно Franco Borsini):
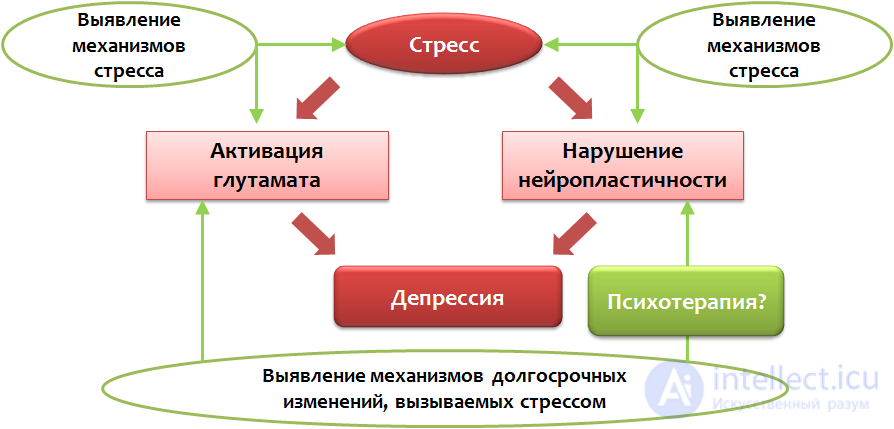 Рис. 39. Borsini F. Models for depression in drug screening and preclinical studies: Future directions // World Journal of Pharmacology. 2012. 1(1). P. 21–29.
Рис. 39. Borsini F. Models for depression in drug screening and preclinical studies: Future directions // World Journal of Pharmacology. 2012. 1(1). P. 21–29.
Прерывание механизмов стресса на ранних этапах позволило бы предотвратить все те изменения, которые рассматривались в контексте нашей статьи. Именно такой способ коррекции, в теории, представляется наиболее эффективным не только для предупреждения развития депрессии, но и для надежной защиты от рецидивов и повторных, более тяжелых эпизодов.
Лекарственная терапия, сама по себе, не является единственным средством коррекции рассматриваемой психопатологии. Не меньшее значение должно уделяться и общению с пациентами, выявлению причины заболевания. В ряде случаев, эффективность психотерапии также имеет высокий потенциал, т.к. помогает найти пути решения проблемы, а не борется с симптомами заболевания, оставляя проблему не решенной и переводя депрессию в субхроническую и хроническую формы.
Исследование, описанное в статье про депрессия, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое депрессия, формы депресси, лечение депрессии, диагностика депрессии и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Психиатрия
Часть 1 Депрессия. Причины, диагностика ,профилактика и лечение, Депрессии в неврологии и нейрохирургии , в период беременности,
Часть 2 Психотерапия - Депрессия. Причины, диагностика ,профилактика и лечение, Депрессии в
Часть 3 Депрессии в период беременности, родов и в климаксе. - Депрессия.
Часть 4 Механизмы нейрогенной активности антидепрессантов - Депрессия. Причины, диагностика ,профилактика и
Комментарии
Оставить комментарий
Психиатрия
Термины: Психиатрия