Лекция
Это продолжение увлекательной статьи про .
...
быть получено лишь при одновременном анализе нескольких снимков, выполненных в различных проекциях.
Интенсивность тени той или другой анатомической структуры зависит от ее рентгенопрозрачности, т. е. способности поглощать рентгеновское излучение. Эта способность, как уже говорилось, определяется атомным составом, плотностью и толщиной исследуемого объекта. Чем тяжелее химические элементы, входящие в анатомические структуры, тем больше они поглощают рентгеновское излучение. Аналогичная зависимость существует между плотностью предметов и их рентгенопроницаемостью. Чем больше плотность исследуемого объекта, тем интенсивней его тень. Именно поэтому при рентгеноскопичсском исследовании обычно легко определяются металлические инородные тела и очень сложен поиск инородных тел, имеющих малую плотность( дерево, различные виды пластмассы, алюминий и др.).
В большинстве случаев анатомические структуры, состоящие из тяжелых химических элементов, имеют высокую плотность. Так, кости, в состав которых входят тяжелые элементы - кальции и фосфор, обладающие наибольшей среди тканей организма плотностью и интенсивностью поглощают рентгеновское излучение, однако в этом случае имеются исключения. В частности известно, что воздух обладает значительно большей рентгенопрозрачностью, чем вода. Вместе с тем азот и кислород (химические элементы, входящие в состав воздуха) тяжелее, чем водород и кислород (химические элементы воды).
В зависимости от плотности принять различать четыре степени прозрачности сред: воздушную, мягкотканную, костную и металлическую. Таким образом очевидно, что при анализе рентгеновского изображения, представляющего собой сочетание теней различной интенсивности, необходимо учитывать химический состав и плотность исследуемых анатомических структур.
Однако следует иметь в виду, что большинство тканей человеческого организма по своему составу и плотности незначительно отличаются друг от друга. Так, мышцы, паренхиматозные органы, мозг, кровь, лимфа, нервы, различные мягкотканые патологические образования (опухоли, воспалительные гранулы), а также и патологические жидкости ( экссудат, транссуда) обладают почти одинаковой рентгенопрозрачностью. Поэтому решающее влияние на интенсивность тени той или иной анатомической структуры оказывает изменение ее толщины.
+Известно, в частности, что с увеличением толщины тела в арифметической прогрессии пучок рентгеновских лучей за объектом (выходная доза) уменьшается в геометрической прогрессии и даже незначительные колебания толщины исследуемых структур может существенно изменить интенсивность их теней. Как видно из рис. 11 при съемке объекта, имеющего форму трехгранной призмы, наибольшую интенсивность имеют участки тени, соответствующие максимальной толщине объекта. Так, если центральный луч направлен перпендикулярно к одной из стен основания призмы, то интенсивность тени будет максимальной в центральном отделе. По мере же передвижения к периферии интенсивность ее постепенно
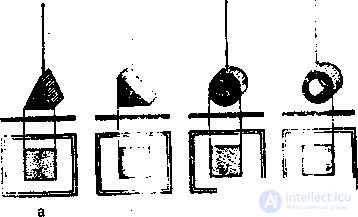
11. Схематическое изображение интенсивности теней различных объектов в зависимости от формы, получения и структуры:
а, б – трехгранная призма, в – сплошной цилиндр, г – полый цилиндр.
уменьшается, что в полной мере отражает изменение толщины тканей, расположенных на пути пучка рентгеновского излучения (рис. 11а). Если же повернуть призму ( рис.11, б) таким образом, чюбы центральной луч был направлен по касательной к какой либо стороне призмы, то максимальную интенсивность будет иметь краевой участок тени, соответствующий максимальной (в данной проекции) толщине объекта. Аналогичным образом возрастает интенсивность теней, имеющих линейную или продолговатую форму, в тех случаях, когда направление их главной оси совпадает с направлением центрального луча (ортоградная проекция).
При исследовании гомогенных объектов, имеющих шаровидную или цилиндрическую форму (сердце, крупные сосуды, опухоль) толщина тканей по ходу пучка рентгеновского излучения меняется очень незначительно. Поэтому тень исследуемого объекта почти гомогенна (рис. 11, в).
Если же шаровидное или цилиндрическое образование является полым, то пучок рентгеновского излучения в периферических его отделах проходит больший объем тканей, что обусловливает появление более интенсивных участков затемнения., так называемых «краевых каемок» (рис. 11, г). Последние на6людаются на снимках трубчатых костей, сосудов с обызвествленными стенками, полостей с плотными стенками и др.
Следует иметь в ввиду, что в практической работе для дифференцированного приятия каждой отдельной тени решающее значение имеет не абсолютная интенсивность, а контрастность, т. е. разница в интенсивности данной и окружающих ее теней. При этом важное значение приобретают физико-технические факторы, оказывающие влияние на контрастность изображения, энергия излучения, экспозиция, наличие отсеивающей решетки, эффективность растра, наличие усиливающих экранов и др. Неправильно выбранные технические условия исследования (чрезмерное напряжение на трубке, слишком большая или недостаточная экспозиция , низкая эффективность растра), а также ошибки при фотохимической обработке пленок снижают контрастность изображения и тем самым оказывают отрицательное влияние на дифференцированное выявление отдельных теней и объективную оценку их интенсивности.
+В основе применения ИИ в ЛТ злокачественных опухолей лежат глубокие знания биологического действия ИИ на различные органы, ткани и опухоли, которое представляет собой чрезвычайно сложный процесс, сопровождающийся определенными морфологическими и функциональными изменениями облучаемой ткани. При этом отчетливо прослеживается сочетание регрессивных явлений с восстановительными, находящимися в тесной зависимости от поглощенной энергии и времени, прошедшего после облучения. Четкие представления об этих процессах послужили основой для успешного применения излучений в лечебных целях как средства, позволяющего уничтожить опухолевую ткань и подавить ее рост, в то же время избежать необратимых постлучевых изменений окружающих опухоль нормальных органов и тканей.
В биологическом действии ИИ первым звеном является поглощение энергии излучения с последующим взаимодействием его с веществом ткани, которое протекает очень короткое время - доли секунды. В результате такого взаимодействия в клетках тканей и органов развивается целая цепь биофизических, биохимических, функциональных и морфологических изменений, которые в зависимости от конкретных условий протекают в различные сроки -минуты, дни, годы. При взаимодействии излучений с веществом возникают ионизация и возбуждение атомов и молекул облучаемого вещества и образуется тепло. При облучении процессы ионизации и возбуждения возникают только вдоль пути ионизирующей частицы.
В результате ионизации атома или молекулы возникает два иона с положительным и отрицательным зарядом. Оба иона нестабильны, химически активны, имеют выраженную тенденцию к соединению с центральными молекулами, при возбуждении которых меняется электронная конфигурация молекулы, что может привести к разрыву ее молекулярных связей. Продукты расщепления прореагировавших молекул также оказываются химически активными и, в свою очередь, вступают в химические реакции с нейтральными молекулами. Ионизация молекул воды, которой в организме более 80%, ведет к ее расщеплению и образованию Н+, ОН, Н2О2, Н2; обладающих значительной химической активностью и вызывающих окисление растворимых в воде веществ.
Таким образом, первичные физические процессы - ионизация и возбуждение атомов и молекул - приводят к химической перестройке облученных молекул. В первичном механизме биологического действия различают прямое действие (изменения, возникающие в молекулах клеток в результате ионизации или возбуждения) и непрямое (объединяет все химические реакции, протекающие с химически активными, но не ионизированными продуктами диссоциации ионизированных молекул).
Процессы ионизации и возбуждения являются пусковыми механизмами, которые определяют все последующие изменения в облучаемых тканях. Возможность ионизации зависит от размеров молекулы: чем больше ее размеры, тем больше вероятность ее взаимодействия с ионизирующей частицей. Все наиболее важные молекулы имеют большой объем. Примером могут служить молекулы ДНК, которые принимают участие в передаче наследственности, в процессах размножения и регуляции обмена в клетке. Облучение приводит к разрыву молекул, нарушению структуры ДНК. В облученной клетке нарушаются процессы регуляции и деятельности ее отдельных составляющих (мембраны, митохондрии и др.). Гибель клеток, даже при облучении большими дозами, может растягиваться на продолжительное время. Различают два вида гибели клеток вследствие облучения: митотическая гибель (инактивация клетки вслед за облучением после первого или последующего митозов) и интерфазная гибель (гибель до вступления ее в фазу митоза).
Непрямое действие излучений вызывает менее грубые нарушения, часто обратимые, но они охватывают большее число молекул в объеме тканей, значительно превышающем размеры полей облучения. Примером непрямого действия может служить общая реакция организма, лейкопения, развивающаяся и в тех случаях, когда костный мозг исключен из зоны облучения.
Интенсивность реакций, связанных с прямым и непрямым механизмами действия ИИ, зависит помимо исходного состояния организма от ряда физических и химических факторов. К физическим факторам относятся доза и ее мощность - с их увеличением биологический эффект усиливается. Также биологический эффект зависит от качества излучения, которое характеризуется ЛПЭ и ЛПИ, так как эффект облучения обусловлен не только количеством поглощенной энергии, но и ее макро- и микрораспределением в тканях.
Из химических факторов, оказывающих влияние на биологический эффект, наиболее отчетливо влияние кислорода. В присутствие кислорода возникает большое количество химически активных радикалов и перекисей, усиливающих процессы окисления в облучаемых тканях. Продолжительность жизни первичных радикалов не превышает долей секунды, а вновь образованные окислители существуют длительное время. При этом могут возникать цепные реакции, а возникающие цепи тем длиннее, чем выше содержание кислорода. Кислород может вступать в реакцию с некоторыми ионизированными молекулами и способствовать их изменению, которое могло бы не проявиться в отсутствие кислорода. Увеличивая интенсивность первичных реакций, развивающихся под влиянием облучения, кислород повышает радиочувствительность клетки, причем повышение это наступает мгновенно вслед за увеличением содержания кислорода. Кислородный эффект наиболее выражен для излучений электромагнитной природы, он выше при фракционированном, чем при однократном облучении.
Введение кислорода в ткани после облучения не оказывает влияния на радиочувствительность клеток, напротив, оно способствует более быстрому восстановлению их после лучевого воздействия. Противоположное действие - снижение радиочувствительности тканей - оказывают так называемые протекторы - вещества, связывающие кислород и радикальные группы и, таким образом, подавляющие развитие реакции непрямого действия.
Изменения химической структуры атомов и молекул под влиянием облучения ведут к развитию в клетках биохимических реакций, не свойственных им в нормальном состоянии. Развивающиеся биохимические изменения весьма разнообразны, и значение их для жизни клетки неодинаково. Нарушаются окислительные процессы, белковый, жировой, углеводный обмены, инактивируются энзимы и ферменты.
МЕТОДЫ ЛУЧЕВОЙ ТЕРАПИИ. ТЕХНИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ЛУЧЕВОЙ ТЕРАПИИ
Для облучения опухоли в необходимой дозе при максимально возможном щажении здоровых тканей организма, особенно тех органов, которые отличаются повышенной радиочувствительностью, разработаны в зависимости от локализации и размеров патологического очага различные технические приемы и методы лучевой терапии.
По расположению источника излучения относительно патологического очага от поверхности тела различают 2 основные группы способов облучения:
S Методы дистанционного облучения
S Методы контактного облучения.
Методы дистанционной лучевой терапии
Дистанционной ЛТ называется лечение, в процессе которого источник излучения находится на расстоянии от 3-5 см до 1 м от поверхности тела пациента.
Методы дистанционной ЛТ определяются видом и качеством ИИ:
S Рентгенотерапия
-S ЛТ тормозным рентгеновским излучением высокой энергии S (3-терапия s у-терапия
s Облучение протонами
-s Облучение нейтронами.
Рентгенотерапия.
Используется рентгеновское излучение низких и средних энергий (40-200 кВ). Источником излучения является рентгеновская (вакуумная) трубка, находящаяся в рентгеновском аппарате. Рентгеновское излучение - это электромагнитные волны (т. е. излучение испускается отдельными порциями - фотонами). Чем меньше длина волны, тем больше энергия фотона. Спектр рентгеновского излучения сплошной, т. е. в пучке энергия фотонов варьирует от нулевой до максимальной.
Для того чтобы пучок рентгеновского излучения состоял из коротких волн (больших энергий), необходимо использовать фильтры, которые отфильтровывают длинноволновое излучение больших энергий. Фильтры - пластинки из металла, изготовленные из алюминия (AI), меди (Си) или AI+Cu, AI+Cu+олово. Качество рентгеновского излучения определяется напряжением на трубке.
Особенности, не позволяющие широко использовать рентгенотерапию для лечения злокачественных опухолей:
s Рентгеновское излучение, которое генерируется с помощью аппаратов для рентгенотерапии, всегда создает максимум поглощенной дозы на поверхности (коже). Величина дозы быстро падает с глубиной.
s Толерантная доза кожи к рентгеновскому излучению небольшая (30-35 Гр).
S Большой вклад рассеянного излучения.
s Небольшая проникающая способность.
Рентгенотерапия применяется для лечения поверхностных
новообразований кожи и слизистых оболочек и для лечения
неопухолевых заболеваний.
Тормозное рентгеновское излучение возникает за счет ускорения и резкого торможения электронов в вакуумных системах различных ускорителей и отличается от рентгеновского большей энергией квантов (от одного до десятков МэВ).
При прохождении потока фотонов через вещество происходит его ослабление в результате следующих процессов взаимодействия (тип взаимодействия фотонов с атомами вещества зависит от энергии фотонов):
Классическое (когерентное, или томпсоновское, рассеяние) - для фотонов с энергией от 10 до 50-100 кэВ. Относительная частота этого эффекта мала. Происходит взаимодействие, которое существенной роли не играет, так как падающий квант, столкнувшись с электроном, отклоняется, и его энергия не меняется.
S Фотоэлектрическое поглощение (фотоэффект) - при относительно малых энергиях - от 50 до 300 кэВ (играет существенную роль при рентгенотерапии). Падающий квант выбивает орбитальный электрон из атома, сам при этом поглощается, а электрон, немного изменив направление, улетает. Этот улетевший электрон называется фотоэлектроном. Таким образом, энергия фотона тратится на работу выхода электрона и на придание ему кинетической энергии.
S Эффект Комптона (некогерентное рассеяние) - возникает при энергии фотона от 120 кэВ до 20 МэВ (т. е. практически весь спектр лучевой терапии). Падающий квант выбивает электрон с наружной оболочки атома, передавая ему часть энергии, и меняет свое направление. Электрон вылетает из атома под определенным углом, а новый квант отличается от первоначального не только иным направлением движения, но и меньшей энергией. Образовавшийся квант будет косвенно ионизировать среду, а электрон - прямо.
*/ Процесс образования электронно-позитронных пар - энергия кванта должна быть больше 1,02 МэВ (удвоенной энергии покоя электрона). С этим механизмом приходится считаться при облучении больного пучком тормозного излучения высокой энергии, т. е. на высокоэнергетических линейных ускорителях. Вблизи ядра атома падающий квант испытывает ускорение и исчезает, преобразовываясь в электрон и позитрон. Позитрон быстро объединяется со встречным электроном, и происходит процесс аннигиляции (взаимного уничтожения), а взамен возникают два фотона, энергия каждого из которых вдвое меньше энергии исходного фотона. Таким образом, энергия первичного кванта переходит в кинетическую энергию электрона и в энергию аннигиляционного излучения.
•S Фотоядерное поглощение - энергия квантов должна быть больше 2,5 МэВ. Фотон поглощается ядром атома, в результате чего ядро переходит в возбужденное состояние и может либо отдать электрон, либо развалиться. Таким образом получаются нейтроны.
В результате вышеперечисленных процессов взаимодействия фотонного излучения с веществом возникает вторичное фотонное и корпускулярное излучение (электроны и позитроны). Ионизационная способность частиц значительно больше, чем фотонного излучения.
Пространственное ослабление пучка фотонов происходит по экспоненциальному закону (закону обратных квадратов): интенсивность излучения обратно пропорциональна квадрату расстояния до источника излучения.
Излучение в диапазоне с энергией от 200 кэВ до 15 МэВ нашло самое широкое применение в терапии злокачественных новообразований. Большая проникающая способность позволяет передавать энергию глубоко расположенным опухолям. При этом резко снижается лучевая нагрузка на кожу и подкожную клетчатку, что позволяет подвести требуемую дозу к очагу поражения без лучевого повреждения указанных участков тела (в отличие от мягкого рентгеновского излучения). С увеличением энергии фотонов больше 15 МэВ увеличивается риск лучевого поражения тканей на выходе из пучка.
+Источниками этого излучения являются линейные ускорители электронов (ЛУЭ), синхротрон, бетатрон. Максимум поглощенной дозы находится глубоко в тканях (на расстоянии 3-5 см от облучаемой поверхности в зависимости от энергии излучения). Используется для облучения глубоко расположенных опухолей (рак пищевода, центральной нервной системы, мочевого пузыря, легкого и др.)
^-излучение представляет собой поток электронов и позитронов, возникающий в результате внутриядерных превращений нейтронов и протонов.
В отличие от а-частиц (3-частицы характеризуются непрерывным энергетическим спектром. Путь электрона в веществе извилист, поскольку он обладает малой массой и легко изменяет направление вследствие соударения с электронами атомов. Поэтому начальный пучок электронов в тканях имеет тенденцию к расхождению (рассеяние электронов). При торможении быстрых электронов в поле ядра атомов возникает тормозное фотонное излучение.
Вследствие большой скорости проникающая способность р-частиц выше, чем у а-частиц. В воздухе она составляет около 10 м, в мышечных тканях - 10 мм. (3-активные препараты используются при лечении злокачественных опухолей, локализация которых позволяет обеспечить непосредственный контакт с этими препаратами. Реже они используются с целью диагностики.
С помощью современных ускорителей создаются электронные пучки высоких энергий (до 15-50 МэВ), обладающие большой проникающей способностью. Средняя длина свободного пробега таких электронов может достигать в тканях человеческого организма 10-20 см. Электронный пучок, поглощаясь в тканях, создает дозное поле, отличающее этот вид излучения от других. Максимум ионизации при этом образуется вблизи поверхности тела. Размеры зоны максимума ионизации находятся в прямой зависимости от величины энергии излучения. За пределами максимума происходит довольно быстрый спад дозы.
-S Может быть использована для облучения поверхностных опухолей
(тангенциальное облучение). s Для лечения неопухолевых заболеваний.
Протонные пучки характеризуются наибольшими массой и зарядом по сравнению с другими видами ИИ. Их траектории также прямолинейны.
ЛПИ, создаваемая положительно заряженными частицами, неравномерна вдоль трека частицы, образует в конце пробега так называемый "пик Брегга", т. е. тяжелые частицы в конце пути дают ЛПИ, в сотни раз превышающую ЛПИ в начале пути (рис. 1). Это объясняется тем, что, замедляясь, тяжелые частицы взаимодействуют с веществом со значительно большей вероятностью. Положение пика Брегга зависит от энергии частиц - чем больше энергия, тем больше глубина его локализации.
Наличие пика Брегга и возможность управления его локализацией на глубине создают благоприятные условия для лучевой терапии протонными пучками высоких энергий. В настоящее время существуют различные устройства, с помощью которых из плазменного шнура, горящего в водородной атмосфере, извлекаются свободные от электронов ядра водорода - протоны. Они ускоряются в циклических ускорителях, приобретая требуемую энергию.
Основными преимуществами использования протонных пучков в лучевой терапии являются формирование не расходящихся пучков и возможность подведения необходимого количества энергии на заданную глубину, соответствующую пику Брегга. При этом ткани, расположенные за пределами пучка, практически не повреждаются. Участок пика Брегга для протонов невелик, но можно использовать пучок с различными энергиями и таким образом разрушить весь очаг поражения.
Это тяжелые заряженные частицы, которые ускоряются с помощью цикло- и синхроциклотрона. Энергия излучения - от 160 до
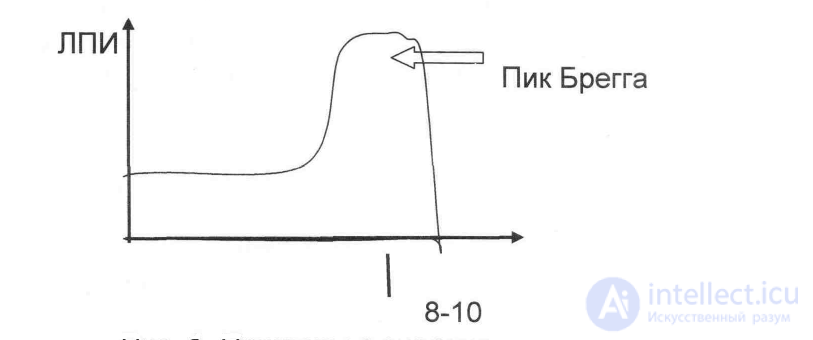
Рис. 1. Протоны с энергией 160-180 МэВ
Электронный пучок, с энергией до 5 МэВ используется при лечении поверхностных злокачественных новообразований, с энергией от 20 до 50 МэВ - более глубоко расположенных. Современные ускорители дают возможность плавно регулировать энергию пучка электронов и тем самым создавать требуемую дозу на любой глубине.
Источники электронов - ЛУЭ, бетатрон, микротрон. Максимум поглощенной дозы находится на глубине эффективного пробега электронов (эффективный пробег равен 1/3 максимальной энергии), т. е. 7-10 см от облучаемой поверхности тела. Величина дозы быстро падает с глубиной. В основном используется для повторной ЛТ или для лечения опухолей, расположенных рядом с критическими органами.
- у-терапия.
^излучение возникает при радиоактивном распаде. Переход ядра из возбужденного в основное состояние сопровождается излучением у-кванта с энергиями от 10 кэВ до 5 МэВ. Основными терапевтическими источниками у-излучения являются у-аппараты (пушки).
В качестве источника излучения используется радионуклид (до недавнего времени - цезий 137, в настоящее время - кобальт 60). Требования к радионуклидам для у-аппаратов:
1. Физический период полураспада должен быть большим: S цезий 137 - 33 года; S кобальт 60 - 5,3 года.
2. Энергия у-лучей должна быть достаточной (1 МэВ и более): S энергия у-лучей цезия - 0,66-0,75 МэВ; S энергия у-лучей кобальта - 1,17-1,33 МэВ.
3. Должна быть сравнительно высокая удельная активность препарата (активность радионуклида в единице объема). Чем больше удельная активность, тем меньше размеры источника излучения. Так как удельная активность кобальта больше, чем у цезия, его удобнее использовать в клинике (в настоящее время размеры таблетки кобальта составляют 1,6 х 1,6 см).
Максимум поглощенной дозы при у-терапии находится прямо под поверхностными слоями кожи, в дальнейшем величина дозы довольно быстро падает (1 см мягких тканей ослабляет у-лучи кобальта на 5%).
Показания для дистанционной у-терапии:
S Для лечения с радикальной, паллиативной и симптоматической целью опухолей внутренних органов.
1000 МэВ. В отличие от фотонных ИИ при облучении протонами максимум ионизации (максимум поглощенной дозы) находится в конце пробега частиц (пик Брегга). Облучение протонами применяется для ЛТ внутричерепных образований небольшого размера, а также для лечения радиорезистентных опухолей с малым диаметром. С помощью протонных пучков удается одномоментно облучать строго ограниченные объемы тканей дозами 100-200 Гр. Облучение нейтронами.
Нейтронные излучения Процессы взаимодействия нейтронов с веществом определяются как энергией нейтронов, так и атомным составом поглощающей среды. Отсутствие у нейтронов электрического заряда позволяет ему проникать через электронные оболочки атомов и свободно приближаться к ядру.
Источники нейтронов:
бомбардировка дейтерия;
смеси а-излучателей с бериллием или бором:
Не + Ве = 13С → 12С + п.
При воздействии на ткани нейтроны захватываются ядрами атомов, что приводит к нарушению их структуры и сопровождается испусканием а- или р-частиц и у-квантов. Кроме того, при ядерных превращениях освобождаются ядра отдачи, которые обладают большой энергией, производят высокую ионизацию среды. Их ионизирующая способность близка к ионизирующей способности а-частиц. Однако поражающее действие нейтронов значительно выше вследствие их большой проникающей способности. При облучении нейтронами в клетке возникает одномоментный разрыв ДНК, что приводит к ее гибели. Так как гибнут не только опухолевые, но и здоровые клетки, для нейтронов характерен высокий процент лучевых повреждений. Из всех видов ИИ быстрые нейтроны обладают наибольшей радиационной опасностью. Быстрые нейтроны лучше замедляются на ядрах легких элементов (вода, парафин, жировая ткань). Следовательно, поглощенная доза оказывается большей в жировой ткани, что приводит к лучевым повреждениям.
Высокая проникающая способность открывает перспективы для использования нейтронов в лучевой терапии злокачественных новообразований.
При решении вопросов защиты от нейтронного излучения необходимо учитывать специфику его взаимодействия с веществом. Для быстрых нейтронов необходимо их замедлить. Для этого используются легкие ядра (вода, парафин). Медленные нейтроны затем поглощаются в результате радиационного захвата в материалах, изготовленных из бора или кадмия. Поскольку процесс захвата сопровождается излучением у-кванта, необходимо использовать в качестве защитного материала свинец. Таким образом, защита от нейтронов является сложной конструкцией.
Нейтронозахватывающая терапия. Впервые метод предложен Locher в 1936 г. При этом методе используется поток медленных нейтронов, получаемых от ядерных реакторов. Для дифференцированного облучения с максимальным эффектом в опухоли и минимальным в нормальных тканях необходимо насыщение опухоли элементами, характеризующимися большим поперечным сечением захвата медленных нейтронов. Такими элементами являются бор (10В) и литий (6Li). Однако туморотропностью эти элементы не обладают. Для обогащения ими опухоли использована различная скорость диффузии их из кровеносной системы в ткани (т. е. эти элементы медленно переходят из крови в головной мозг, а в опухолевую ткань поступают значительно быстрее). Установлено, что через 30 минут после внутривенного введения соединений бора его концентрация в опухоли мозга в 4-5 раз выше, чем в нормальной ткани. И именно в это время должно проводиться облучение, Концентрация бора и лития в мышечной ткани очень велика, и поэтому нейтронозахватывающую терапию нельзя применять при опухолях туловища и конечностей. Этот метод применим только при опухолях мозга.
Проводится в 31 центре в мире, где есть генераторы нейтронов. Применяется для ЛТ радиорезистентных опухолей, саркомы костей, мягких тканей. Терапевтический эффект достигается только ценой лучевых повреждений.
Дистанционная ЛТ может осуществляться в статическом и подвижном режимах.
При статическом облучении источник излучения неподвижно зафиксирован по отношению к пациенту. Для изменения поля действия пучка излучения используются экранирующие блоки и решетки из свинца.
При подвижном способе облучения источник излучения двигается по дуге относительно тела больного. Различают: S круговое облучение (угол вращения 360°); s маятниковое, или секторное, облучение (угол качания меньше
360°).
Показаниями для этих видов подвижного облучения являются небольшие опухоли, расположенные в области центральной и сагиттальной плоскости тела больного (т. е. глубоко расположенные). К ним относятся опухоли головы и шеи, бронхопульмональные лимфатические узлы, опухоли пищевода, прямой кишки, мочевого пузыря и др.
-S Эксцентрическое (шалевидное) облучение - радиус качания
+составляет с центральным лучом определенный угол отклонения. Применяется, например, при лечении метастатических очагов в ребрах, при облучении селезенки, т. е. органов, расположенных близко к поверхности тела больного.
Контактные методы облучения - это такие методики ЛТ, при которых источник ИИ находится на расстоянии менее 30 см от облучаемого объекта. Различают следующие виды контактной ЛТ:
-S аппликационная ЛТ;
S внутриполостное облучение;
•S внутритканевая ЛТ.
Основной особенностью дозного поля при всех контактных методах ЛТ является быстрое падение мощности дозы по мере отдаления от препарата на протяжении уже первого сантиметра, что позволяет создать высокую дозу излучения в патологическом очаге с крутым падением мощности дозы за его пределами. Эта особенность является преимуществом метода, так как при этом окружающие опухоль нормальные ткани подвергаются минимальному облучению.
При аппликационной ЛТ источники ИИ помещаются непосредственно на поверхности тела больного без нарушения целостности тканей. Источник излучения представляет собой излучающую поверхность, имеющую различные формы, размеры и кривизну. В настоящее время используются (3-аппликаторы, содержащие Sr90 и Y90 (лечение офтальмологических заболеваний), у-аппликаторы содержат препараты Со60 и представляют собой специальные маски-муляжи, моделирующие форму облучаемой области (лечение поверхностно расположенных новообразований: рак кожи, губы, рецидивы рака молочной железы и др.). Аппликационная ЛТ выполняется в течение 5-10 дней, причем ежедневные процедуры проводятся в течение нескольких часов.
Внутриполостное облучение производят путем введения источника излучения в естественные (полость рта, матки; пищевод, прямая кишка) или искусственно образованные (послеоперационная рана и др.) полости. Первоначально на практике больному накладывали аппликатор, обычно уже заряженный радиоактивными источниками. Это приводило к облучению персонала во время выполнения этой процедуры; торопясь, источники располагали хуже, чем следовало. В настоящее время эту методику заменили способом последовательного введения (afterloading), по которому сначала в тело больного вводят пустой держатель или направляющий канал для источников, затем рентгенологически проверяют их положение. Лишь убедившись в том, что это положение правильное, больного переводят в изолированное или имеющее необходимую защиту помещение и вводят ему радиоактивные источники. Для осуществления внутриполостной ЛТ имеется серия шланговых аппаратов разной конструкции, позволяющих автоматизированным способом размещать источники вблизи опухоли и осуществлять ее прицельное облучение.
Внутритканевая ЛТ. Помимо введения закрытых радиоактивных источников в полости тела больного можно вводить непосредственно в опухоли или размещать на поверхностях опухолей иглы, гранулы, проволоки, содержащие радиоактивные источники. Их располагают по
продолжение следует...
Часть 1 6. Аппараты и системы для воздействий рентгеновским и радиоизотопным излучениями.
Часть 2 Биологические основы лучевой терапии - 6. Аппараты и системы для
Часть 3 Действие облучения на злокачественную опухоль - 6. Аппараты и системы
Комментарии
Оставить комментарий
Электронная лечебная аппаратура
Термины: Электронная лечебная аппаратура