Лекция
Привет, Вы узнаете о том , что такое аппаратура для поддержки кровообращения, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое аппаратура для поддержки кровообращения, искусственное сердце , настоятельно рекомендую прочитать все из категории Электронная лечебная аппаратура.
Искусственное кровообращение (ИК) - временное замещение газообменной функции легких и насосной функции сердца специальными устройствами на период, необходимый для выполнения кардиохирургической операции.
Вспомогательное кровообращение улучшение сократительной способности миокарда достигается двумя путями:
В настоящее время основные технологии лечения тяжелыми формами сердечной недостаточности (ТФСН)основаны:
Искусственное кровообращение обычно используется при операциях на сердце. Этот метод позволяет хирургической бригаде насыщать кислородом и обеспечивать циркуляцию крови пациента, что позволяет хирургу оперировать сердце. Во многих операциях, таких как шунтирование коронарной артерии (АКШ), сердце останавливается (то есть останавливается) из-за сложности операции на бьющемся сердце. Операции, требующие открытия камер сердца, например, восстановление или замена митрального клапана., требует использования Cardiopulmonary bypass (CPB), чтобы избежать системного захвата воздуха и обеспечить бескровное поле для увеличения видимости для хирурга. Аппарат перекачивает кровь и с помощью оксигенатора позволяет эритроцитам собирать кислород, а также снижает уровень углекислого газа. Это имитирует работу сердца и легких соответственно.
Системы МПК используются у трех категорий пациентов .
К первой группе относятся пациенты, которых
после проведения операции на открытом сердце
невозможно отключить от аппарата искусственного
кровообращения (ИК) (2–8% пациентов). Длительность такой поддержки составляет от нескольких
дней до нескольких недель.
Ко второй группе относятся пациенты с острым
поражением сердечной мышцы (инфаркт миокарда,
острый миокардит и др.). В этом случае для преодоления периода возникшей критической сердечной
недостаточности (СН) необходима временная гемодинамическая поддержка. Вероятность восстановления нормальной деятельности сердца через
определенный период времени в сочетании с интенсивной медикаментозной терапией достаточно
высока .
К третьей группе относятся пациенты с хроническими тяжелыми формами сердечной недостаточности.
Последняя группа предусматривает разные подходы при определении стратегии использования МПК:
В соответствии с данной классификацией разрабатывались методы и требования к системам
для кратковременной МПК (от нескольких дней
до месяца – пациенты первой и второй группы,
хотя имеются варианты использования кратковременной МПК для внеплановой ТС) и методы и
требования длительной МПК – пациенты третьей
группы.
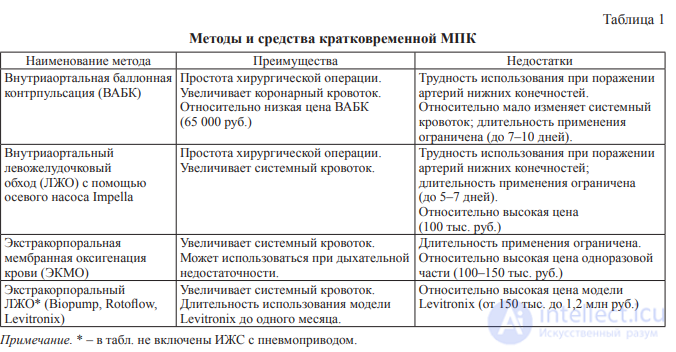
В табл. 1 представлены основные методы и средства для кратковременной МПК
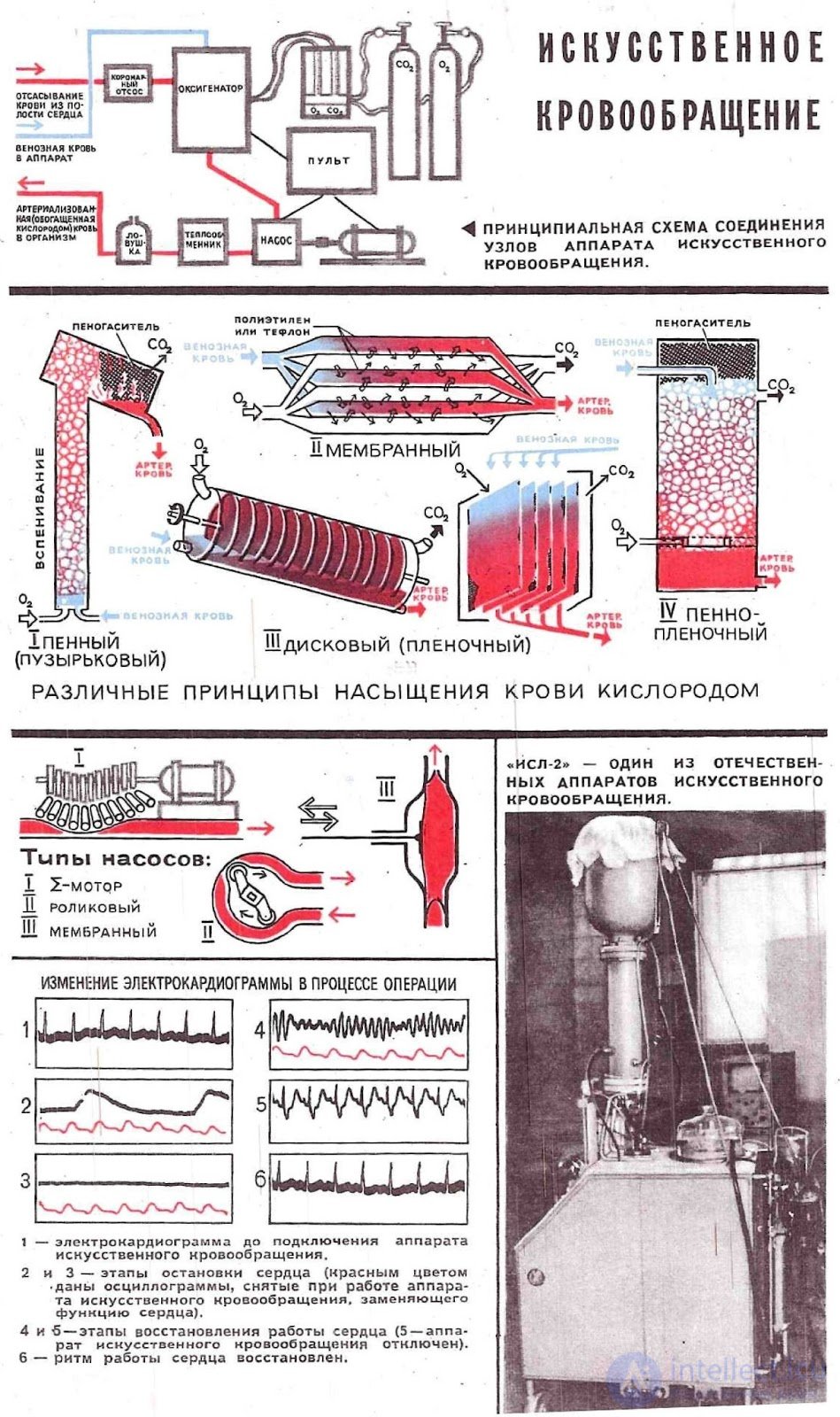
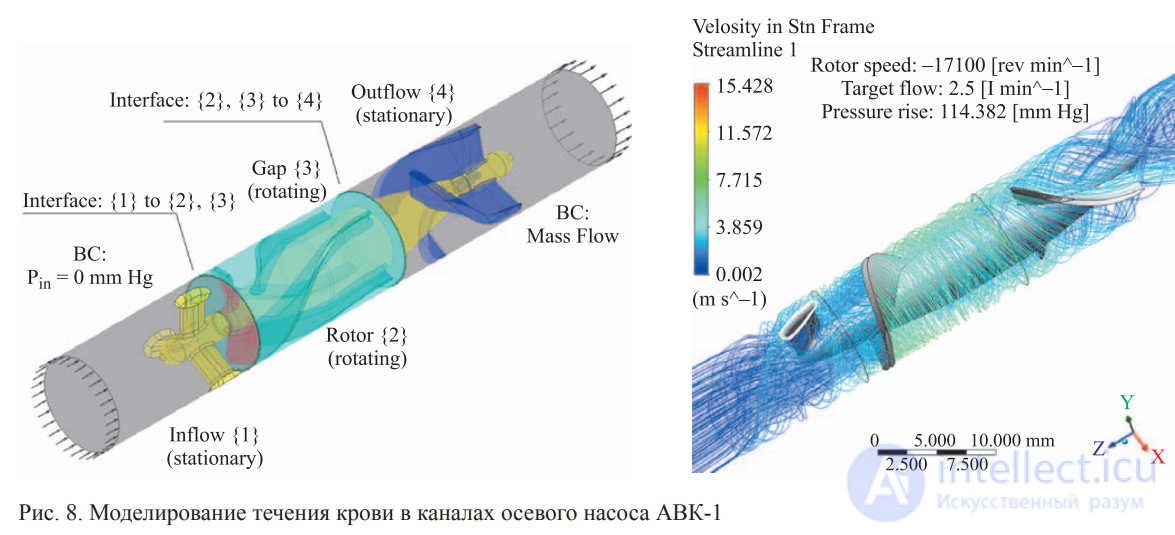
Конструктивно аппарат представляет собой совокупность, состоящую из консоли с насосами и блоком управления с необходимым набором датчиков и вспомогательной оснастки (инфузионные стойки, полки из нержавеющей стали, венозный зажим). На подвижной консоли устанавливаются роликовые насосы с частотой вращения роликов до 250 об/мин, что позволяет получать потоки крови от 0 до 11,2 литров в минуту на трубках ½". Один из насосов (артериальный) перекачивает кровь из венозной системы в артериальную. Второй — предназначен для дренажа левого желудочка сердца, третий — для отсоса крови из раны и возвращения ее в экстракорпоральный контур, четвертый и пятый насосы используют для различных режимов кардиоплегии. Для уменьшения размеров аппарата и обеспечения согласованных режимов кровяной кардиоплегии насосы могут быть объединены в единый насосный модуль с 2 независимыми моторами в едином корпусе и с совместным электронным модулем контроля. Кроме насосов аппарат снабжен блоком контроля давления, электротермометром, смесителем газов, таймерами, детекторами уровня и пузырьков — объединенными в блок управления.
Насосы для крови используют трех типов: создающие отдельно систолу и диастолу (основаны на принципе изменения объема камеры мембраной при помощи гидравлической или пневматической среды); создающие кровоток в гибких трубках расширением или сжатием (клапаны размещены в просвете трубки или вне ее); создающие кровоток прерывистой волной (роликовые и пальчиковые). Все насосы для крови по механизму действия разделяются на насосы с постоянным и переменным ударным объемом, а по характеру создаваемого ими тока крови на насосы с малой и большой пульсацией. Для реализации температурных режимов используют теплообменник с терморегулирующим устройством. Система управления обеспечивает заданные режимы работы как отдельных функциональных узлов, так и аппарата в целом.
Аппарат искусственного кровообращения приводят в действие при помощи гидравлического, пневматического или электромеханического приводов. При аварийном режиме применяют ручной привод. В мире создано множество различных по назначению аппаратов искусственного кровообращения: для изолированной химиотерапии злокачественных новообразований, воспалительных процессов и деструктивных поражений; для вспомогательного искусственного кровообращения при нарушениях сердечной и дыхательной функции; для реанимации больных, находящихся в состоянии клинической смерти; для поддержания жизнедеятельности изолированных органов, предназначенных для последующей пересадки. Все аппараты имеют общую структурную схему и отличаются друг от друга производительностью, особенностями систем управления или дополнительными специальными функциональными узлами.
Насосы для крови используют 3 типов: 1) создающие отдельно систолу и диастолу; основаны на принципе изменения объема камеры мембраной при помощи гидравлической или пневматической среды; 2) создающие кровоток в гибких трубках расширением или сжатием; клапаны в этих насосах размещены в просвете трубки или вне ее и 3) создающие кровоток прерывистой волной (роликовые и пальчиковые). Все насосы для крови по механизму действия разделяются на насосы с постоянным и переменным ударным объемом, а по характеру создаваемого ими тока крови на насосы с малой и большой пульсацией. Для реализация температурных режимов, соответствующих цели операции, т. е. для проведении искусственного кровообращения в условиях нормальной или пониженной температуры, используют теплообменник с терморегулирующим устройством. Система управления обеспечивает заданные режимы работы как отдельных функциональных узлов, так и аппарата в целом. АИК приводят в действие при помощи гидравлического, пневматического или электромеханического приводов. При аварийном режиме применяют ручной привод.
В мире создано более 100 типов различных по назначению АИК: для изолированной химиотерапии злокачественных новообразований, воспалительных процессов и деструктивных поражений; для так называемого вспомогательного искусственного кровообращения при тяжелых нарушениях сердечной и дыхательной функции; для оживления больных и пострадавших, находящихся в состоянии клинической смерти; для поддержания жизнедеятельности изолированных органов, предназначенных для последующей пересадки, и т. д. Все аппараты имеют общую структурную схему (рис. 1) и отличаются друг от друга производительностью, особенностями систем управления или включения дополнительных специальных функциональных узлов. Об этом говорит сайт https://intellect.icu . Схемы подключения АИК к сосудистой системе организма больного зависят от выбранного варианта искусственного кровообращения. Среди АИК для хирургии сердца распространенными являются модели аппаратов, в которых « искусственное сердце » представлено роликовыми насосами, а «искусственные легкие» — дисковым оксигенатором [аппараты«Реmсо», «Sarens», «Imico» (США), ИСЛ-4, АСП-2 (СССР)]. У советских аппаратов этого назначения АИК-5 (рис. 2), АИК-5М физиологический блок состоит из мембранных насосов и пенно-пленочного оксигенатора.
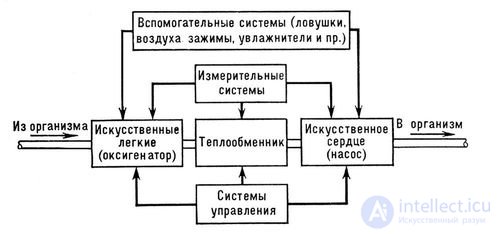
Рис. 1. Блок-схема аппарата искусственного и кровообращения.

Рис. 2. Аппарат искусственного кровообращения АИК-5 кардиохирургического назначения.
Принцип работы
Аппарат искусственного кровообращения временно замещает функцию сердца и легких. Поэтому он состоит из нескольких блоков, а именно:
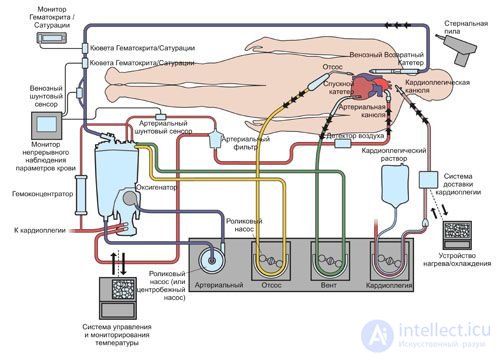
Схема и техника подключения АИК могут быть различными в зависимости от операционного доступа и вида патологии сердца (или сосуда). Для нагнетания крови чаще используют одну из бедренных или подвздошных артерий, откуда ретроградно кровь поступает в брюшную и грудную аорту, затем в ее дугу, проходя в сосуды, питающие мозг и сердце (коронарные сосуды). Иногда артериализированную кровь нагнетают через канюлю в восходящий отдел аорты. Дренирование венозной системы производят либо с помощью двух пластмассовых катетеров, введенных в обе полые вены через правое предсердие либо с помощью одного катетера, введенного в правое предсердие или желудочек. Венозная кровь поступает в оксигенатор АИК, где насыщается кислородом, и насосом АИК направляется в артериальную систему больного. Обе эти манипуляции производят после введения в кровь больного гепарина в дозе 2—3 мг на 1 кг веса тела. Для большей безопасности больного канюлирование артериальной системы должно предшествовать катетеризации венозного русла .
Проведение искусственного кровообращения начинают с одновременного включения артериального насоса и снятия зажимов с венозной линии аппарата, не допуская полного оттока крови из организма. Синхронно увеличивая производительность насоса и величину венозного притока, доводят объемную скорость перфузии до расчетной (2,2—2,4 л/мин на 1 м² поверхности тела). В дальнейшем руководствуются критериями адекватности перфузии.
Длительность искусственного кровообращения зависит от характера патологии и колеблется от нескольких минут (ушивание дефекта межпредсердной перегородки, ликвидация изолированного клапанного стеноза легочного ствола) до многих часов (одновременное протезирование нескольких клапанов сердца) .
Переход на естественное кровообращение начинают с постепенного или одномоментного прекращения поступления крови в аппарат с одновременным уменьшением производительности артериального насоса. Нагнетание крови в артерии полностью прекращают по достижении оптимального объема циркулирующей крови в сосудистом русле больного, о чем судят по величине центрального венозного давления, которая должна составлять в этот момент 150—180 мм водного столба.
В случае длительного искусственного кровообращения (свыше 1 часа) целесообразно сочетать его с искусственной гипотермией, которая сопровождается снижением потребности организма в кислороде, что позволяет уменьшить объемную скорость перфузии, а тем самым и травму форменных элементов крови. В большинстве случаев достаточна умеренная гипотермия (температура в пищеводе не ниже 28°). Глубокая гипотермия до 15—10° применяется крайне редко, при необходимости временной полной остановки кровообращения.
При проведении искусственного кровообращения широко применяют метод управляемой гемоделюции, то есть разбавления циркулирующей крови замещающими жидкостями (например, низкомолекулярными растворами электролитов, сахаров или белков) .
Для клинических испытаний на человеке этот аппарат был еще не готов, так как при его применении происходила массивная травмати-зация частиц крови.
Рассмотрим современные аппараты искусственного кровообращения.
Их назначением является временная замена функций сердца и легких. В АИК имеются два основных узла:
Основные требования, предъявляемые к аппаратам искусственного кровообращения:
На рис. 143 изображена общая схема АИК.
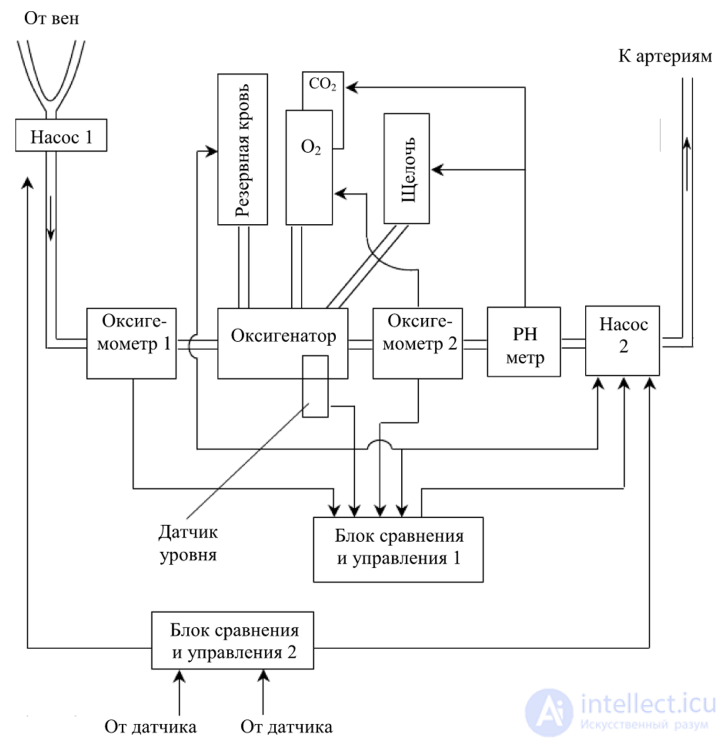
венозного артериального
давления давления
Рис. 143. Схема АИК
В состав АИК дополнительно входят:
АИК работает следующим образом. Кровь, взятая из вен, поступает через насос 1 (рис. 143), регулирующий скорость подачи крови в оксигенатор, перед которым происходит замер оксигемометром 1 количества О2 в венозной крови. Оксигенатор насыщает кровь О2 посредством управления источником О2, который регулируется с блока сравнения и управления 1, поступает информация с оксигемометра 2. Затем кровь поступает к насосу 2, при этом измеряется pH крови, и при уменьшении щелочи в крови она добавляется в оксигенатор, при уменьшении кислотности в оксигенатор поступает СО2. Затем кровь через насос 2 поступает к артериям пациента. При этом постоянно замеряется давление в венозном и артериальном руслах датчиками давления и через блок сравнения и управления 2 управляющие сигналы поступают на насосы 1 и 2, посредством которых достигается необходимое давление в системе кровоснабжения пациента.
Сегодня существует более 30 конструкций АИК, из них наиболее широко используются АИК:
Проблемы очистки аппаратов. Особое внимание уделяется тракту крови по аппарату, перед операцией он промывается содой и мылом.
Кипячение и автоклавирование АИК и его деталей. Перед эксплуатацией сначала происходит прогонка 1 л спирта в системе АИК, затем прогоняется 1,5...2 л физраствора, все эти растворы прогоняются по трактам аппарата 20.. .30 мин.
Применяется донорская кровь (около 500 г), она заливается в оксигенатор.
Дополнительно нужно отметить, что в процессе использования в реанимационных медицинских технологиях, кроме того, для интенсивной терапии, используются аппараты вспомогательного кровообращения при слабой работе сердца. В это же время параллельно идет лечение основного заболевания, вызывающего слабость сердца, при больших кровопотерях, отравлениях, инфекционных заболеваниях.
Далее рассмотрим примеры конструкций АИК.
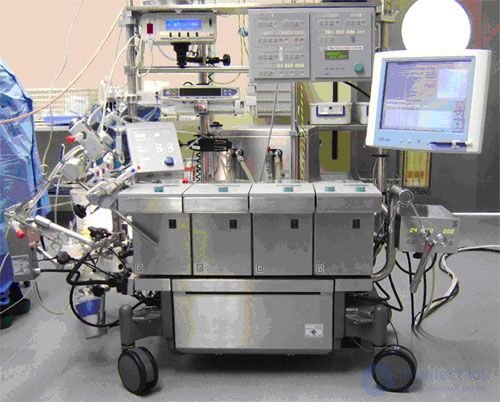
Аппараты искусственного кровообращения MAQUET HL-30
В АИК MAQUET (рис. 144) воплощена совершенно новая концепция конструкции и функциональности аппаратов искусственного кровообращения. Система, с одной стороны, удовлетворяет требованиям методов перфузии сегодняшнего дня и будущих разработок, а с другой стороны, представляет собой совершенное с технической точки зрения сочетание четкого функционального дизайна, максимальной гибкости, передовой технологии и надежности.

Рис. 144. АИК MAQUET HL-30
MAQUET представляет последнее поколение аппаратов искусственного кровообращения. Перфузиологи всегда испытывали потребность в гибкой, эргономичной и оснащенной передовыми технологиями системе, которая при этом остается надежной и удобной в работе.
Аппарат искусственного кровообращения HL-30 может быть конфигурирован с учетом комфортных рабочих условий для любого пользователя: невысокий или высокий, правша или левша, предпочитает работать сидя или стоя - все это не имеет значения. Ключевым фактором является индивидуальная настройка для достижения максимальной гибкости и оптимальной эргономики.
Основа системы представляет собой устойчивую компактную консоль со стойками, с помощью которых мониторы, насосы и прочее оборудование может быть закреплено на регулируемых по высоте поворотных кронштейнах различной длины, которые настраиваются в соответствии с индивидуальными потребностями. Это позволяет разместить все устройства в оптимальных для пользователя положениях.
Система АИК HL-30 дает перфузиологам возможность размещать насосы, оксигенатор и трубки в максимально удобных положениях вблизи пациента. В результате значительно уменьшается длина подводящих трубок и сводятся к минимуму первичные объемы заполнения. В любой момент к имеющейся системе можно добавить новую аппаратуру или реконфигурировать систему.
Искусственное сердце (рис. 145), или искусственные желудочки, применяются у больных в терминальной стадии сердечной недостаточности для спасения их жизни и поддержки кровообращения до того момента, когда найдется подходящее для пересадки донорское сердце.


Рис. 145. Искусственное сердце
Насосы различных конструкций (поршневые, баллонные, мембранные, ротационные) помещаются в грудную клетку или располагаются снаружи и подсоединяются катетерами к больному сердцу. Одни из них берут на себя функции всего сердца, другие - лишь одного желудочка.
Самая первая операция по имплантации искусственного сердца 58-летнему мужчине потерпела неудачу.
Американская компания Abiomed впервые разработала постоянное искусственное сердце. Оно смогло бы помочь пациентам, для которых невозможно лечение собственного сердца или имплантация донорского. Разработка в течение нескольких лет испытывалась и совершенствовалась на нескольких добровольцах.
Портативное искусственное сердце, созданное на новых принципах работы в 2007 году группой специалистов во главе с профессором Энди Таном из Института биомедицинских инноваций (Австралия) (рис. 146), относится к так называемым бивентрикулярным вспомогательным устройствам. Это означает, что новый насос поддерживает одновременно и правую, и левую половины больного сердца. Обычная проблема с такими устройствами - габариты, так как фактически требуется разместить в грудной клетке два отдельных насоса.
Рис. 146. Портативное искусственное сердце
Новый так называемый «насос противопотока», созданный
Э. Таном, впервые совмещает обе функции в одном механизме. Он обладает двумя рабочими колесами, перегоняющими кровь и вращающимися как одно целое. При этом обеспечивается правильное давление в каждой из половинок сердца.
Э. Тан отмечает, что у больных, которым имплантировали искусственный левый желудочек (такие «половинчатые» вспомогательные устройства пока более распространены), на 47 % снижался риск смерти в течение следующего года. Так что механическое вспомогательное сердце, обслуживающее обе половинки естественного кровяного насоса, еще больше повысит шансы пациентов на выживание.
Аппарат «Искусственное сердце» предназначен для сбора крови из операционной раны и ее реинфузии и позволяет производить операции в общей хирургии, травматологии и ортопедии, гинекологии, сосудистой, неотложной хирургии без переливания донорской крови. Применение аппарата позволяет исключить возможность возникновения осложнений, связанных с трансфузией донорской крови (антигенная несовместимость, посттрансфузионные осложнения, заражение инфекционным гепатитом, СПИД).
В первых образцах аппаратов искусственного сердца (ИС) автоматическому управлению уделялось мало внимания. Главным образом решелись вопросы создания оптимальной конструкции, поиска гемосовместимых материалов, создания малогабаритных надежных приводов. Кроме того, отсутствие количественно обобщенных, комплексных сведений о свойствах и характеристиках сердечно-сосудистой системы и регуляции сердечного выброса также затрудняло выбор оптимальной стратегии управления ИС.

Вместе с тем при построении систем управления ИС исследователи сталкиваются с методическими трудностями надежного, непрерывного измерения параметров организма. В связи с этим чаще всего используют системы управления с ручной регулировкой режима работы насоса по отдельным показателям центральной гемодинамики.
В настоящее время практически все исследовательские центры в мире, занимающиеся разработкой ИС, начали исследования по созданию систем автоматического управления. При этом можно выделить четыре направления в создании систем управления ИС.
1. Создание систем управления на основе ограниченной и специфической исходной информации, имеющейся у исследователей. Обычно источником информации является в этом случае датчик одной из переменных в ИС. Поскольку такой датчик является одним из звеньев в замкнутой системе управления ИС (при участии оператора или в полностью автоматизированной системе), возможности получения исходной информации во многом определяют и принципы построения систем управления. Чаще всего применяют емкостной датчик положения диафрагмы насоса для крови. Его основное назначение – получение первичной информации о производительности насоса.
2. Второе направление основано на чисто механической замене органов ручного управления автоматическими регуляторами. При этом алгоритм управления выбирается эмпирически, исходя из экспертных оценок работы операторов, управляющих работой ИС в эксперименте. Примером этого направления может служить первая версия модернизации аппарата для управления ИС «Витамек».
3. Третье направление – построение систем управления на основе изучения динамики основных физиологических переменных в системе кровообращения. На данном принципе построены практически все системы стабилизации той или иной переменной, например давления крови в предсердиях или аортальном резервуаре.
Известно, что в организме не существует контура стабилизации давления в предсердии. Однако в диапазоне физиологических условий это давление изменяется в незначительных пределах, что позволило некоторым исследователям использовать контур сервоуправления, позволяющий стабилизировать давление в предсердии. Ввиду особенности длительного функционирования ИС в системе кровообращения использование подобных параметров для управления связано как с методическими, так и с техническими трудностями, делающими работу аппаратов малонадежной и неточной.
4. Четвертое направление в управлении ИС – изучение механизмов регуляции сердечного выброса и воспроизведение основных регуляторных характеристик сердца. Это направление – наиболее сложное, поскольку до настоящего времени в физиологии сердца и кровообращения нет достаточно полной количественной информации о взаимодействии регуляторных процессов, существенно связанных с системой кровообращения. Данное направление предполагает глубокое понимание процессов регуляции сердечного выброса, знание количественных отношений и закономерностей в этих процессах и построение соответствующих моделей, на которых могут быть обработаны те или иные алгоритмы управления ИС.
В настоящее время в управлении ИС наибольшее распространение нашли алгоритмы, основанные на воспроизведении механизма Франка-Старлинга. Этот механизм считается основным алгоритмом регулирования естественного сердца, хотя он и подвержен влиянию многочисленных нервных и гуморальных каналов управления.
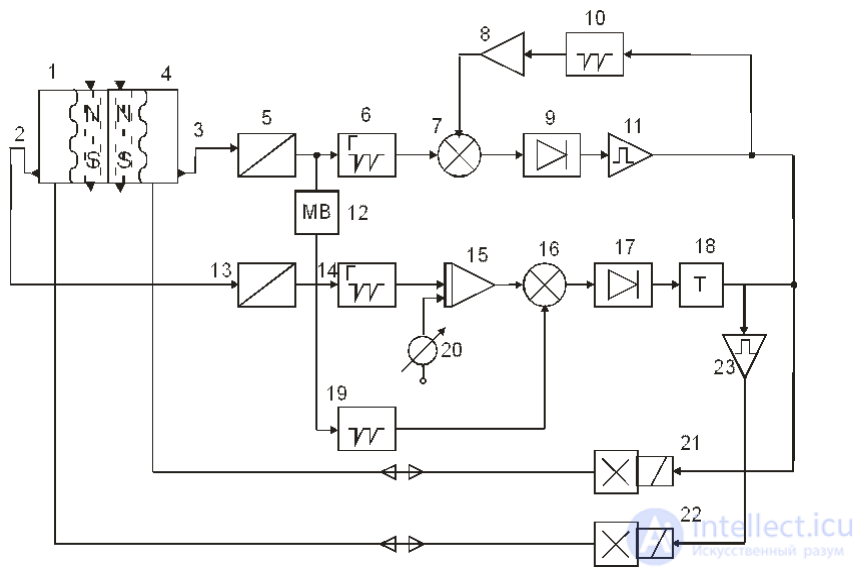
На рис. 7.7 представлена блок-схема системы управления длительностью фазы нагнетания в зависимости от скорости наполнения желудочка. Рассмотрим работу левого канала управления.
 =
=
Рис. 7.7 – Блок–схема системы автоматического управления искусственным кровообращением
При заполнении левого желудочка (4) кровью магнит, вмонтированный в рабочую диафрагму со стороны пневмокамеры, замыкает контакты геркона (3), установленного в корпусе левого желудочка. Сигнал с геркона через нормализатор (5) запускает генератор линейно падающего напряжения (6). Напряжение генератора (6) сравнивается с помощью компаратора (7) с напряжением, пропорциональным частоте сокращений и длительности фазы всасывания левого желудочка. Это напряжение получается за счет усреднения сигналов генератора линейно нарастающего напряжения (10). Последний запускается по окончании фазы нагнетания и сбрасывается в момент начала фазы нагнетания. Компаратор (7) срабатывает, когда напряжение генератора (6) превышает напряжение на выходе усреднителя (8). На выходе компаратора, выполненного по типу блокинг-генератора с обмотками положительной и отрицательной обратной связи, формируется пакет высокочастотных импульсов, которые выпрямляются детектором (9). Импульсы на выходе детектора усиливаются усилителем мощности (11) и подаются на электропневмоклапан (21) управления левым желудочком.
Таким образом, левый канал определяет частоту и длительность сокращений ИС. При увеличении, например, давления на входе в левый желудочек он будет заполняться быстрее. Напряжение на выходе генератора (6) уменьшится. При этом длительность фазы нагнетания увеличивается, приводя к увеличению ударного выброса и нормализуя увеличение частоты сокращений левого желудочка.
Исследование, описанное в статье про аппаратура для поддержки кровообращения, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое аппаратура для поддержки кровообращения, искусственное сердце и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Электронная лечебная аппаратура
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Электронная лечебная аппаратура
Термины: Электронная лечебная аппаратура