Лекция
Это продолжение увлекательной статьи про .
...
т.д.), указанные в описании в тест-системе, устанавливает исследуемый планшет в плашкодержатель и нажимает кнопку "Пуск", все остальное - измерение, обработку и распечатку результатов прибор производит автоматически.
"УНИПЛАН" - современный дизайн, жидкокристаллический дисплей, принципиально новое программное обеспечение: работа в режиме диалога, возможность набора формул расчета, указанной в тест-системе, с последующим сохранением заданных параметров; запоминание кривой, построенной по стандартам и т.д., до 99 программ.
Прибор "Униплан" может быть использован, в лечебных учреждениях здравоохранения, Госсанэпиднадзора, ветеринарии и т.д. :
- для проведения всех видов иммунологических исследований, таких как: диагностика СПИД, гепатитов А, В и С, гриппа, герпеса простого, краснухи, кори, оспы, сифилиса, коклюша, дифтерии, пневмококковой инфек-ции, туберкулеза, менингита, токсоплазмоза, бруцеллеза, туляремии, столбняка, альфеококкоза, эхинококко-за, раковоэмбрионального антигена и т.д.;
- для определения различных классов иммуноглобулинов (аллерген специфических иммуноглобулинов, миог-лобина, фибрин-фиброгена и т.д.);
- для определения гормонов (гормон щитовидной железы [Т4, Т3], диагностика беременности [ХГ], кортизол, прогестерон, пролактин, гормон гипофиза [ТТГ] и т.д.);
- для диагностики аутоиммунного процесса щитовидной железы;
- для определения ферментов и других биологически активных веществ.
Прибор обеспечивает:
- автоматическую фиксацию планшета при установке в измерительный отсек;
- распечатку результатов в виде таблицы по форме, соответствующей планшету, на стандартную бумагу форматом А4 с помощью малогабаритного принтера;
- возможность подключения любого имеющегося у Вас принтера с параллельным интерфейсом, совместимым с IBM PC;
- возможность подключения внешнего компьютера через линию "RS232" (соединительный кабель и программное обеспечение поставляются по отдельному заказу);
- запоминание полученных результатов и возможность просмотра их с помощью клавиатуры;
- звуковую сигнализацию всех режимов и окончания работы;
- диагностику возможных ошибок оператора.
Люминесцентный микроскоп БИОМЕД 2Л предназначен для иммунологических исследований с применением флюоресцирующих и ферментных меток, а также гистологических и цитологических исследований в клинической лабораторной диагностике.
Микроскоп БИОМЕД 2Л — тринокуляр, объективы Флюорат, 10х, 20х, 40х, 100хМИ, осветитель 25 Вт, возбуждение 360-550 нм, запирающий фильтр 420-650 нм, ртутная лампа 100 Вт/2, фазовый контраст.
ЭЛЕКТРОФОРЕЗ
Приборы, основанные на электрофоретическом принципе, используются в клинической лаборатории для измерения количеств различных типов белков в плазме, моче и спинномозговой жидкости. Они также применяются для разделения ферментов на составляющие их изоферменты, для идентификации антител и для ряда других приложений.
В общем случае явление электрофореза может быть определено как движение твердой фазы относительно жидкой (буферного раствора). Основная функция буферного раствора заключается в том, что он проводит электрический ток и поддерживает постоянное значение рН раствора в процессе миграции. Буферный раствор стабилизируется твердой матрицей, называемой поддерживающей средой.
Наше обсуждение в данном разделе будет ограничено зональным электрофорезом. В этой методике образец вводится в поддерживающую среду, и под действием электрического поля частицы с одинаковым зарядом, одинакового размера и формы, мигрируют с одинаковой скоростью. Это приводит к разделению частиц по зонам. Факторы, влияющие на скорость миграции частиц в электрическом поле, описываются в следующих параграфах:
Величина заряда. Подвижность данной частицы непосредственно зависит от суммарной величины ее заряда. Подвижность определяется как «расстояние, выраженное в сантиметрах, которое частица проходит за единицу времени при единичной напряженности поля, выраженной как падение напряжения на сантиметр» [подвижность = см /(В • сек)].
Ионная сила буфера. Чем больше концентрация буфера, тем меньше скорость миграции частиц. Это происходит потому, что чем большую долю суммарного заряда составляют буферные ионы, тем большую долю суммарного тока они несут. Кроме того, это происходит вследствие взаимодействия буферных ионов с частицами.
Температура. Подвижность непосредственно зависит от температуры. Сопротивление поддерживающей среды проходящему току производит тепло. Это тепло влияет на электрофоретический процесс двумя путями. Во-первых, оно вызывает рост температуры поддерживающей среды, что приводит к уменьшению ее сопротивления и, как следствие, к увеличению скорости миграции. Во-вторых, тепло вызывает испарение воды с поверхности поддерживающей среды. Это приводит к увеличению концентрации частиц и еще более увеличивает скорость миграции. Вследствие этих эффектов, для достижения приемлемой воспроизводимости результатов процедуры необходимо поддерживать на постоянном уровне либо приложенное напряжение, либо силу тока. Для коротких разделений при относительно невысоком напряжении можно поддерживать постоянным как напряжение, так и ток. Однако, при использовании в качестве поддерживающей среды различных гелей, нагревание является существенной проблемой. Для минимизации выделения тепла в средах этого типа обычно используются источники, поддерживающие постоянную силу тока.
Время. Длина миграции непосредственно зависит от времени, в течение которого протекает электрофоретический процесс. Другие факторы, влияющие на миграцию, включают в себя явления электроосмоса и хроматографии, форму частиц, «барьерный» эффект, «фитильный поток» и потенциал течения.
Типы поддерживающих сред. В различных приложениях электрофоретиче-ских методик используется широкое разнообразие поддерживающих сред. В их числе — бумага, ацетат целлюлозы, крахмальный гель, агаровый гель, акриламидный гель и сахароза. Здесь мы обсудим электрофорез на ацетате целлюлозы, поскольку этот метод широко применяется в клинических лабораториях, и его общий принцип подходит и для других поддерживающих сред.
Пленки из ацетата целлюлозы имеют ряд преимуществ перед фильтровальной бумагой, которая изначально использовалась в качестве поддерживающей среды для электрофореза.
На рис. 11.9 представлена схема устройства для электрофореза на ацетате целлюлозы. Полоска ацетата целлюлозы пропитывается буферным раствором и устанавливается в держатель мембраны («мостик»), «Мостик» устанавливается в «кювету», при этом оба конца полоски погружаются в отсеки с буферным раствором.
Денситометр — это прибор, включающий в себя источник света, фильтр и детектор (обычно фотодиодный).
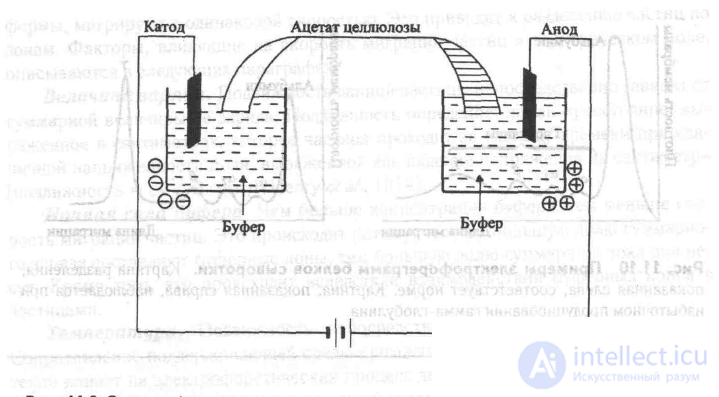
Рис. 11.9 Электрофорез на ацетате целлюлозы.
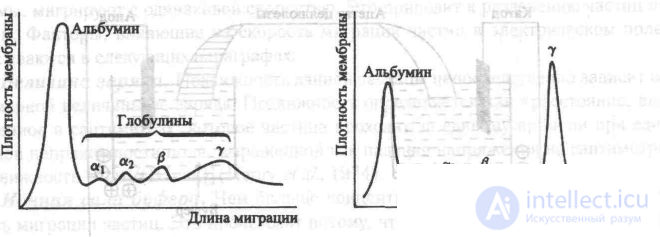
Рис. 11.10 Примеры электрофореграмм белков сыворотки. Картина разделения, показанная слева, соответствует норме. Картина, показанная справа, наблюдается при избыточном продуцировании гамма-глобулина.
Автоматические химические анализаторы
Рассмотрим два важнейших типа автоматических химических анализаторов. Это Синхрон СХ4 (Synchron CX4) производства Beckman, и Клини ческий Автоанализатор (АКА) производства DuPont. Оба эти прибора значительно увеличивают производительность клинической лаборатории и уменьшают время получения результата при экстренных запросах (так называемые экстренные запросы 57/47). Синхрон СХ4 является сравнительно новым прибором, АКА — более старым, но широко используемым. В обеих системах для проведения основных измерений используются спектрофотометрические методы. Приборы отличаются способами выполнения этапов отбора образца, разбавления, смешивания образца с реагентами, физического перемещения образца, обсчета и регистрации результатов. ,ницй мэкуЭ иМ .RiiKSiiiBqa вг-.нки ечгм'лр-шшшв п вкмгртнн спои СИНХРОН СХ4 .; :а\эоп гэасня 08 ~н ке!\жб/< ;not-j
pqna-ruH От^чЛчЖУГ, ч имчпя ,1.4 ЧМНР.ЯООМТТ}Т Г.П.ХН11 ИП6Т€
Система Синхрон СХ4 (Synchron CX4) является современным высокопроизводительным химическим анализатором (Anonymous, 1989). Это клинический анализатор с произвольным порядком выполнения операций способен выполнять широкий набор тестов в одном запуске. Он имеет ряд возможностей, представляющих интерес с точки зрения перспектив биомедицинской технологии. Эти возможности включают в себя автоматическое манипулирование образцом, применение целого ряда аналитических методик, широкое использование микрокомпьютеров и принципы идентификации по штрих-коду. Этот прибор является химическим анализатором с произвольным порядком действия, контролируемым микрокомпьютером. Он проводит анализ конечных результатов и выполняет кинетические тесты (при 30 С или при 37 С). .M,,nn,JN хнннэюы,.,Ыа хите Н ^атээи: •>» отомзт.^ ,;n.EHS HHimqr Рабочие характеристики. Оператор управляет работой прибора СХ4 с помощью монитора и клавиатуры. Доступ к иерархической системе рабочих окон осуществляется с помощью восьми функциональных клавиш. (Назначение каждой клавиши отображается в нижней части экрана.) Основными являются пять функций: программирование образцов, загрузка реагентов, калибровка, специальные функции и параметры системы. ю ra'<HHOHUJfR3q н аотнэтеео иопЛ :aomeqOo дагю :им
1. Программирование образцов. С помощью этой функции оператор может обозначить материал, содержащийся в определенной чашке, как анализируемый или контрольный образец, ввести информацию для идентификации материала, и указать, каким тестам этот материал должен быть подвергнут. Предусмотрены специальные процедуры, позволяющие провести экстренный анализ образцов. С помощью системного принтера можно получить список типов материала, который предполагается поместить в каждую из чашек в секторе образцов (список загрузки). Характеристики сектора образцов будут обсуждаться ниже. Этот список используется при размещении в секторе полученных от пациентов и контрольных образцов.
2. Загрузка реагентов. Эта процедура позволяет оператору вставлять, извлекать и заменять патроны с реагентами в 24 гнездах на барабане реагентов. Каждый патрон с реагентами имеет этикетку со штрих-кодом, содержащим полную информацию о нем, включая тип теста, в котором он используется, и его срок годности. Считывающее устройство снимает информацию со штрих-кода при установке или извлечении патрона из барабана, и эта информация передается главному процессору системы.
3. Калибровка. Для обеспечения точности и надежности измерения используются материалы с известными концентрациями анализируемых веществ (стандартные образцы). Калибровка осуществляется как в момент загрузки реагентов в систему, так и через определенные промежутки времени.
5. Параметры системы. В этом режиме оператор может контролировать текущее рабочее состояние прибора, текущую конфигурацию системы (например, , типы активных тестов), и показания различных датчиков прибора (например, тэгтемпературы и уровни жидкостей).
В тестах конечной точки для вычисления концентрации анализируемого вещества используются результаты последнего из измерений оптического поглощения продуктов реакции. В тестах кинетического типа используется тот факт, что скорость изменения оптического поглощения в реакционной смеси зависит от концентрации анализируемого вещества. В этих вычислениях используются данные измерений, относящихся к наиболее линейному участку кинетической кривой реакции.
Процедура анализа данных включает в себя вычисление концентрации анализируемого вещества по показаниям оптического поглощения. Каждая из этих концепций будет обсуждаться ниже более подробно.
Описание системы. Система СХ4 включает в себя три основные подсистемы: блок образцов, блок реагентов и реакционную систему.
Блок образцов Блок образцов состоит из пяти модулей: секторы образцов (до восьми), система автоматической загрузки, поворотный стол для образцов, пробоотборник-смеситель, и чашка для промывки пробоотборника-смесителя. Сектор образцов может нести до десяти чашек с образцами, полученными от пациентов, либо с контрольными образцами. Оператор вводит информацию, идентифицирующую материал в каждой из чашек, с помощью компьютерной системы управления (выше). Система автоматической загрузки переносит секторы с образцами на барабан образцов под управлением микрокомпьютера. В этом процессе используются шаговый двигатель и пневмогидравлическая система. По завершении цикла тестирования сектор аналогичным образом снимается с барабана. Поворотный стол для образцов состоит из барабана образцов и оптического считывающего устройства. Барабан образцов является поворотным устройством с дискретными положениями, и приводится в движение шаговым двигателем. Управление поворотами осуществляется микрокомпьютером таким образом, чтобы анализируемый материал был доступен для пробоотборника. Пробоотборник имеет датчик уровня жидкости, что позволяет ему погружать иглу пробника на правильную глубину, обеспечивая тем самым возможность отбора правильного количества анализируемого материала. После того, как анализируемый материал попадает в пробоотборник, крановая система поворачивает пробоотборник в такое положение, чтобы игла пробника находилась над кюветой на реакционном барабане. Затем материал сливается в кювету.
2. Блок реагентов Блок реагентов включает в себя патроны с реагентами, барабан реагентов и дозатор реагентов. Патроны с реагентами являются одноразовыми емкостями, в которых содержатся реагенты, необходимые для определенного теста. Они имеют этикетки со штрих-кодом, указывающим тест, в котором они используются. Барабан реагентов вращается под управлением микрокомпьютера, подавая нужный реагент к дозатору. Барабан реагентов несет 24 патрона.
3. Реакционная система Реакционная система включает в себя реакционный барабан и фотометрический блок. Реакционный барабан несет 80 кювет, в которых протекают химические реакции. В кюветах поддерживается постоянная температура в 30°С, либо 37°С. Фотометрический блок состоит из ксеноновой лампы, коллиматорной системы, оптических фильтров и фотодиодных детекторов. Ксеноновая лампа выдает вспышку света всякий раз, когда кювета проходит через оптический блок. Вследствие того, что вспышки имеют переменную интенсивность, используется система коррекции вспышек. Эта система основана на проведении измерений поглощения на частотах, отличных от основной частоты измерения. Свет, прошедший через кювету с образцом, попадает в коллиматорную систему, которая разделяет его на лучи, направленные через каждый из десяти фильтров (340, 380, 410, 470, 520, 560, 600, 650, 670 и 700 нм) на десять фотодиодных детекторов. Каждый из детекторов выдает сигнал, пропорциональный интенсивности падающего на него света. Сигналы проходят через логарифмическую цепь усиления и подаются на вход коммутатора. Коммутатор, управляемый микрокомпьютером, в определенные моменты производит замер сигнала, и передает аналоговый сигнал на аналогово-цифровой преобразователь. Данные измерений поглощения в цифровом представлении передаются центральному процессору системы.
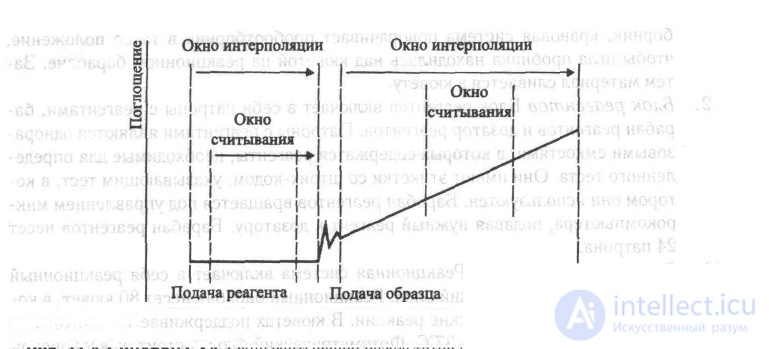
+Рис. 11.4 Синхрон СХ4. Окно считывания результатов для измерений кинетического типа
Автоматический клинический анализатор (АКА) производства фирмы DuPont отличается от высокопроизводительных приборов, подобных Синхрону СХ4, своей универсальностью, а не максимальной производительностью. Он выполняет измерения последовательно, а не параллельно, но при этом для каждого биологического образца он может автоматически осуществить любой набор из 40 тестов. Функциональная блок-схема АКА представлена на рис. 11.5.
Принцип действия АКА основан на концепции автоматических манипуляций с кассетами биологических образцов (КБО) и с кассетами химических реактивов (КХР). Для каждого биохимического теста используется отдельная КХР. В процессе работы прибора КХР перемещается от блока к блоку по транспортеру, причем для данного образца можно выбрать любую последовательность КХР. Время, требуемое для проведения любого определения с помощью АКА, составляет 7 минут, интервал между определениями составляет 37 секунд. Это означает, что анализатор может провести любой анализ как экстренный. Эта особенность предоставляет клинической лаборатории важные дополнительные возможности, однако она же приводит к увеличению стоимости анализов по сравнению с другими автоматизированными методами.
Рассмотрим основные характеристики АКА. Образец, полученный от пациента, помещается в КБО, к которой прикреплена идентификационная карточка пациента. КХР, соответствующие тестам, которые предполагается провести для данного образца, устанавливаются на конвейер позади КБО. Конструкция КХР показана на рис. 11.6. За последней КХР на конвейере следует специальная кассета, завершающая рабочий цикл. Каждая из подсистем прибора выполняет следующие основные функции:
Идентификация пациента. Когда КБО устанавливается в АКА в первый раз, она проходит через блок, который считывает и распечатывает информацию, вручную записанную на идентификационную карточку пациента, прикрепленную к КБО.
Блок заполнения. В блоке заполнения из комплекта образца отбираются али-квоты (отмеренные объемы жидкости) и смешиваются с разбавителем, который может быть различным для разных определений. Затем в каждый пакет КХР вводятся по 5 мл смешанного раствора. Двоичные коды, нанесенные на каждую КХР, считываются электронными устройствами блока заполнения, чтобы определить, какой именно разбавитель использовать для данного пакета КХР. После заполнения КХР перемещаются к нагревателям, а КБО помещаются в выходной лоток.
Нагреватели. В нагревателях пакет КХР подогревается до 37°С, и эта температура поддерживается до конца процесса.
Вскрыватель-миксер 1. В этом блоке разрушаются четыре пластиковых капсулы с реактивами, которые смешиваются с разбавленным образцом (рис. 11.6).
Станции задержки. По мере того, как пакет КХР последовательно проходит пять станций ожидания, в нем протекают химические реакции между первыми четырьмя реагентами, разбавляющим раствором и образцом.
Вскрыватель-миксер 2. В этом блоке вскрываются три оставшиеся капсу лы с реагентами, и их содержимое добавляется в реакционную смесь. Для некото-рых тестов на этом этапе предусматривается определенная задержка, позволяющая химическим реакциям пройти до конца перед тем, как КХР попадет в фотометрический блок. Эта задержка определяется по двоичному коду, указывающему тип теста, который считывается в блоке заполнения.
Фотометр. В фотометрическом блоке с помощью особого пресса пластиковый конверт КХР преобразуется в кювету. При этом в пластиковом пакете измеряется давление, а результат измерения используется для того, чтобы опреде-
лить, правильное ли количество образца и разбавителя было введено в КХР. Если давление слишком мало, результаты теста помечаются символом «Р» (от слова pressure, давление). Двоичный код КХР считывается заново, после чего схема управления фотометра выбирает метод измерения, тип фильтра и параметры АЦП.
АКА использует один из трех методов измерения: кинетический, двухфильтро-вый и двухкассетный (с двумя КХР). Для определения концентрации анализируемого вещества по кинетическому методу, поглощение света в кювете измеряется дважды. При этом промежуток времени между измерениями строго фиксирован. В рамках двухфильтрового метода измерение поглощения осуществляется с двумя разными светофильтрами. Концентрация анализируемого вещества пропорциональна разности между полученными значениями поглощения света. При работе по двухкассетному методу, на одной и той же длине волны определяется разность поглощения света смесью из анализируемого вещества и реагентов двух разных КХР. Выходной сигнал фотометра преобразуется в цифровую форму, задаваемую контроллером фотометра, и пересылается на принтер.
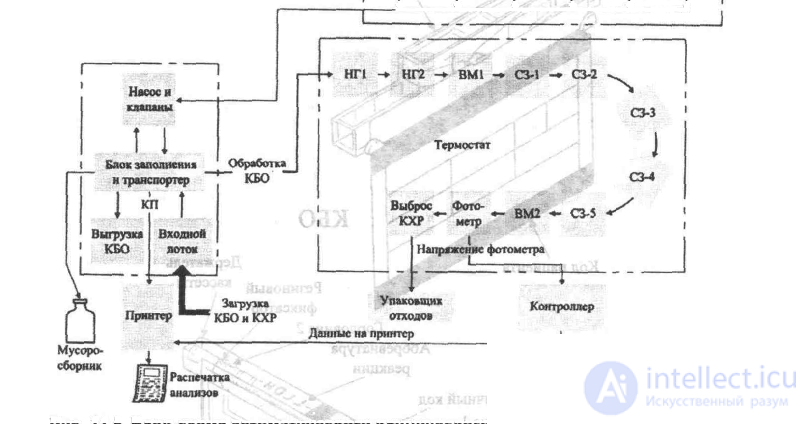
Рис. 11.5 Блок-схема автоматического клинического анализатора (АКА). КБО = кассета биологических образцов. КХР = кассета химических реактивов. Разб. = разбавитель, Нагр. = нагреватель, ВМ = вскрыватель-миксер, СЗ = станция задержки. КП = код пациента.
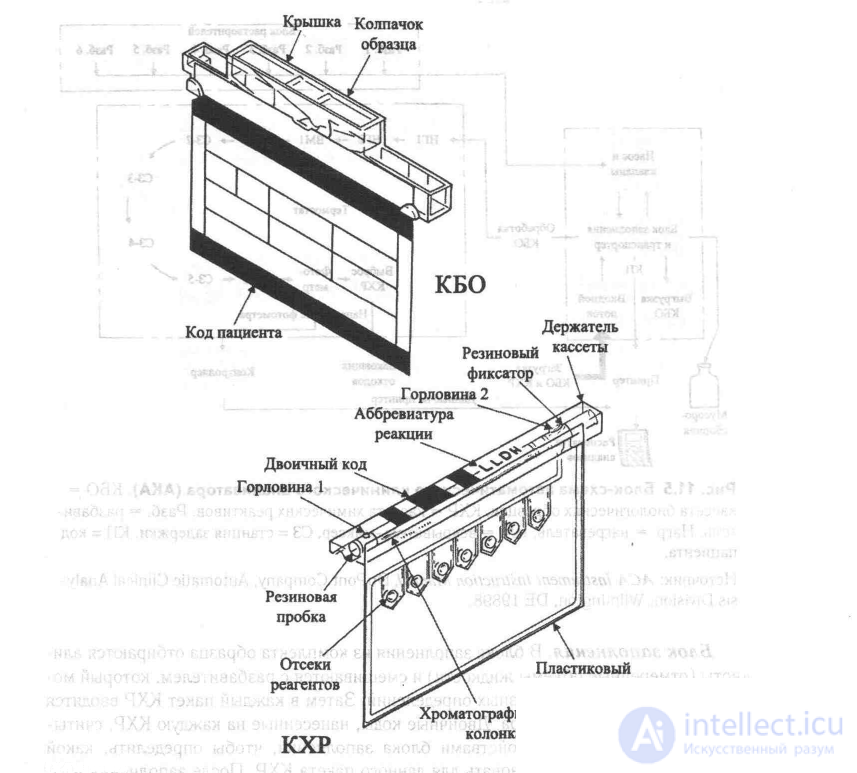
+Рис. 11.6 Кассета биологических образцов (КБО) и кассета химических реактивов (КХР) автоматического клинического анализатора (АКА).
Хроматология представляет собой группу методов, предназначенных для разделения смесей веществ на компоненты. Заметим, что хотя термин «хроматография» уже прочно устоялся, в действительности его употребление ошибочно: в современных методиках для идентификации веществ не используют цвета компонентов смесей. Одна из фаз (жидкая или твердая) является неподвижной, а другая (жидкая или газообразная) — подвижной. Если в качестве неподвижной используется жидкая фаза, то процесс называется распределением. Если в качестве неподвижной используется твердая фаза, то процесс называется адсорбцией.
Для разделения компонентов смеси, в хроматологии используют разность в скорости их движения в подвижной фазе, вызванную взаимодействием этих веществ с неподвижной фазой.. В хроматографических методах используются четыре возможные комбинации подвижной и неподвижной фаз.
С точки зрения применения в клинической лаборатории, эти методы используются в первую очередь для детектирования сложных веществ, таких как лекарственные препараты и гормоны. Например, с помощью газожидкостной хроматографии (ГЖХ) и тонкослойной хроматографии (ТСХ) удобно определять, какой именно препарат (или препараты) использовался в случае его передозировки. Наличие этой информации жизненно необходимо для врача, который должен выбрать надлежащие терапевтические процедуры..
Основные элементы ГЖХ показаны на рис. 1 1.7. Перед вводом в ГЖХ полученный от пациента образец обычно подвергается процедуре предварительной очистки, степень которой зависит от выполняемого анализа. Основные подсистемы хроматографа выполняют следующие функции: Инжектор. Инжектор предназначен для ввода в ГЖХ 1 —5 мл раствора образца (обычно в летучем органическом растворителе). Температура в инжекторе такова, что растворитель с образцом мгновенно испаряются.
Газ-носитель. Инертный газ-носитель (обычно это N2 или Не) является подвижной фазой хроматографа. Он несет испаренный образец и газообразный растворитель вниз по колонке.
Колонка. Колонка обычно имеет длину 1 м и диаметр менее 7 мм. Она упакована твердой поддерживающей матрицей (например, диатомовой землей). На твердую матрицу нанесена жидкая фаза. Малый размер твердых гранул обеспечивает разделение компонентов. Колонка помещена в термостат, температура в котором тщательно контролируется. Программатор температуры постепенно увеличивает температуру колонки в последовательности, подобранной для получения максимальной эффективности выделения именно того вещества, которое анализируется.
Детектор. Детектор располагается на конце колонки. Его функция заключается в том, чтобы выдавать электрический сигнал, пропорциональный количеству вещества в выходящем потоке газа. Имеется ряд типов детекторов, предназначенных для использования с различными типами образцов. Среди них — ионизационные детекторы, детекторы по теплопроводности и электронозахватные детекторы. Для применения в клинической лаборатории наиболее часто используются ионизационные детекторы (Littlewood, 1970).
Все детекторы чувствительны к целым классам веществ, а не к какому-либо одному определенному анализируемому веществу. Таким образом, для определения типов и количеств отдельных компонентов, присутствующих в образце, используются как концентрации детектируемых веществ, так и периоды времени, по истечении которых эти концентрации регистрируются (т.е. график зависимости концентрации от времени). Электрический выход детектора подключается к самописцу.
Самописец. У самописца по оси х откладывается время, а по оси у— интенсивность выходного сигнала детектора. Таким образом, хроматограмма показывает как количества присутствующих компонентов (площади соответствующих пиков), так и времена удержания, с которыми эти вещества элюируются из колонки. Исходя из этой информации, присутствующие компоненты могут быть идентифицированы по их временам удержания или, предпочтительнее, путем сравнения с хроматограмма-ми, полученными в результате ГЖХ-анализа веществ известной структуры.

Рис. 11.7 Блок-схема газожидкостного хроматографа (ГЖХ).
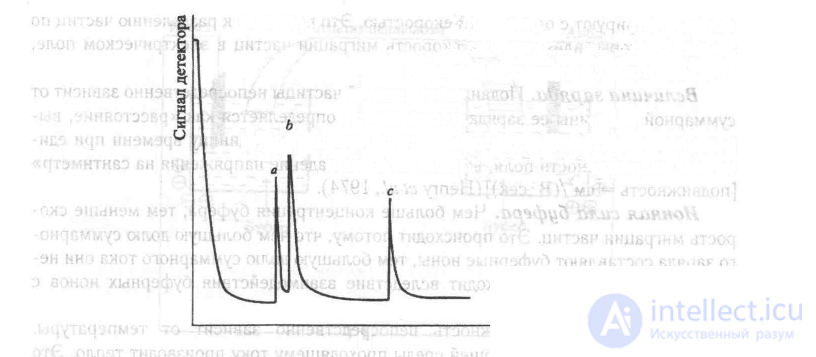
Рис. 11.8 Пример хроматограммы ГЖХ для анализа уровня содержания в крови фенобарбитала (пик а) и фенитоина (пик с). Пик b соответствует уровню гептабарбитала (внутренний стандарт).
ГЕМАТОЛОГИЯ
ОСНОВНЫЕ ПОНЯТИЯ
Кровь состоит из форменных элементов, растворенных веществ и воды. В этом разделе описаны только те приборы, которые измеряют характеристики форменных элементов: эритроцитов (ЭРЦ), лейкоцитов (ЛКЦ) и тромбоцитов (ТРЦ). Основной функцией ЭРЦ является перенос кислорода из легких к различным органам и перенос двуокиси углерода из этих органов к легким для его выведения из организма. Основной функцией ЛКЦ является участие в защите организма от инфекций. В периферической крови в норме обнаруживаются пять типов ЛКЦ. В порядке уменьшения содержания в крови взрослого человека, это нейтрофилы, лимфоциты, моноциты, эозинофилы и базофилы. При заболеваниях суммарные количества и пропорции ЛКЦ этих типов могут изменяться; могут также появляться незрелые и злокачественно трансформированные типы ЛКЦ. Тромбоциты затыкают мелкие разрывы в стенках кровеносных сосудов, а также участвуют в механизме свертывания крови.
Основным показателем
продолжение следует...
Часть 1 16 Аппаратура для анализов
Часть 2 Газожидкостные хроматографы - 16 Аппаратура для анализов
Часть 3 - 16 Аппаратура для анализов
Комментарии
Оставить комментарий
Электронная лечебная аппаратура
Термины: Электронная лечебная аппаратура