Лекция
Привет, Вы узнаете о том , что такое 2 Аминокислоты и белки, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое 2 Аминокислоты и белки , настоятельно рекомендую прочитать все из категории Пищевая химия.
2.1 Общая характеристика белков
Белки – это высокомолекулярные соединения, состоящие из остатков
α-аминокислот соединенных пептидной связью. Количество остатков молекул
α-аминокислот в одной молекуле белка может достигать нескольких тысяч. В
состав белков могут входить 20 наименований α-аминокислот.
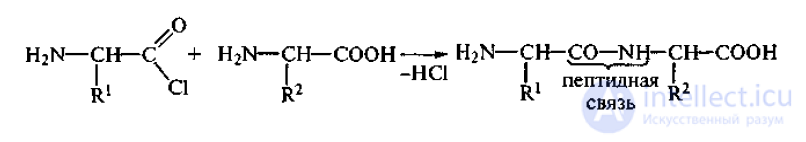
Пептидная связь – это связь, образующаяся между карбоксильными
группами и аминогруппами молекул аминокислот.
При усвоении 1 грамма белка выделяется 4 ккал или 16,74 кДж энергии. Для
взрослого человека достаточно 1-1,2 г белка в сутки на 1 кг массы тела, т. е. в
среднем примерно 70-90 г. Для детей потребность в белке значительно выше: до
1 года – более 4 г белка на 1 кг массы тела, для 2-3-летних – 4 г, для 3-5-летних –
3,8 г, для 5-7-летних – 3,5 г. Повышенная потребность в белке у детей объясняется
тем, что в растущем организме преобладают процессы синтеза и белок пищи
необходим не только для поддержания азотистого равновесия, но и обеспечения
формирования и роста тела. Рекомендуемое содержание белков в рационе человека
по калорийности составляет 11-12 %. На долю белков животного происхождения
должно приходиться 55 %, а растительного происхождения 45 % от суточной
потребности. Белки составляют примерно 20 % массы человеческого тела и
более 50 % сухой массы клетки.
В тканях человека белки не депонируются (не накапливаются), поэтому
необходимо ежедневное их поступление с пищей. Без достаточного количества
белков не могут быть использованы витамины, минеральные вещества, необходимые
для процессов обмена веществ.
2.2 Строение белковой молекулы
Различают первичную, вторичную, третичную, четвертичную структуры
белковых молекул.
1. Первичная структура белковой молекулы представляет собой соединение
аминокислот в простейшую линейную цепь за счет только пептидных связей. Под
первичной структурой белка понимают вид, число, последовательность
аминокислотных остатков в полипептидной цепи.
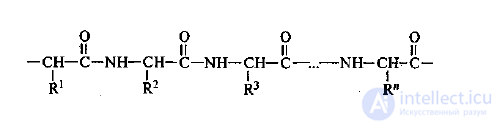
2. Вторичная структура белковой молекулы представляет собой
пространственное расположение полипептидной цепи в виде α-спирали или
β-складчатой структуры (рисунок 1). Структура удерживается за счет
возникновения водородных связей между отдельными участками белковой
молекулы.
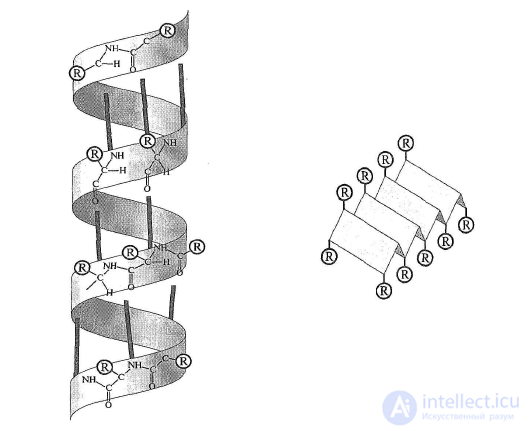
Рисунок 1 – Схема вторичной структуры белковой молекулы
(спиралевидная и складчатая)
3. Третичная структура белковой молекулы представляет собой
специфическое пространственное укладывание α-спирали в виде глобул (шаров)
(рисунок 2) или фибрилл (нитей).
Рисунок 2 – Схема третичной структуры белковой молекулы (глобула)
Поддержание характерной пространственной третичной структуры белковой
молекулы осуществляется за счет взаимодействия боковых радикалов аминокислот
между собой с образованием связей: водородных, дисульфидных,
электростатических, гидрофобных.
4. Четвертичная структура белковой молекулы представляет собой
соединение нескольких отдельных субъединиц белка в одну укрупненную
структуру, обладающую новыми свойствами, не характерными для отдельных
субъединиц (рисунок 3). Субъединицы удерживаются за счет возникновения
водородных, ионных связей, ван-дер-ваальсова взаимодействия,
электростатического взаимодействия разноименно заряженных групп молекул.

Рисунок 3 – Схема четвертичной структуры белковой молекулы
2.3 Классификация белков
Классификация по форме молекул. По форме молекул различают:
- глобулярные белки – шаровидные белки (ферменты, антитела, многие
гормоны, миоглобин, гемоглобин, сывороточный альбумин), хорошо растворяются в
воде;
- фибриллярные белки – нитевидные белки (белки волос, ногтей, сухожилий,
связок), в воде не растворимы.
Классификация по строению и составу. Белки по строению и составу
белковой молекулы разделяются на две группы (рисунок 4):
- простые (протеины) белки – состоят только из остатков α-аминокислот;
- сложные (протеиды) белки – содержат помимо остатков α-аминокислот
вещества небелковой природы.
Сложные белки подразделяются на следующие группы:
- липопротеиды – содержат кроме белка липиды;
- гликопротеиды – состоят из белка и высокомолекулярных углеводов;
- хромопротеиды – содержат кроме белка красящие вещества - пигменты;
имеющие в своем составе металлы, например гемоглобин содержит железо;
- нуклеопротеиды – состоят из белка и нуклеиновых кислот;
- фосфопротеиды – содержат кроме белка фосфорную кислоту.
Классификация по растворимости. По растворимости различают четыре
вида белков (рисунок 5):
- альбумины – водорастворимые белки;
- глобулины – солерастворимые белки, растворяются в 5-10 % растворе
хлорида натрия;
- глютелины – щелочерастворимые белки, растворяются в 0,1-0,2 % растворе
гидроксида натрия;
- проламины – спирторастворимые белки, растворяются в 60-80 % растворе
этилового спирта.
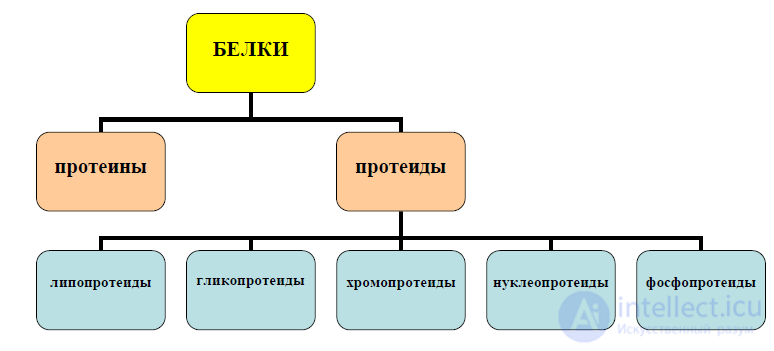
Рисунок 4 – Классификация белков по строению и составу
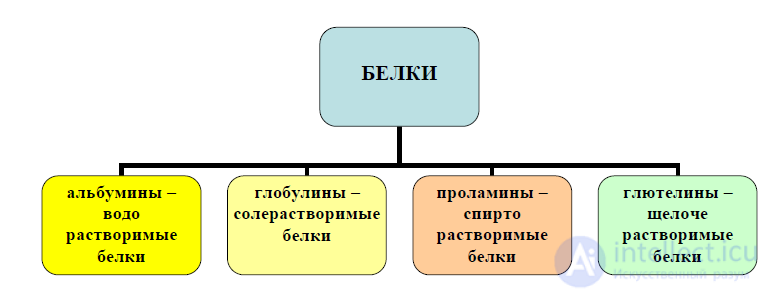
Рисунок 5 – Классификация белков по растворимости
Классификация по функциям в организме. По функциям в организме белки
можно разделить на четыре группы (рисунок 6):
- структурные белки – входят в состав клеток, тканей и органов организма;
- ферменты – биокатализаторы (ускорители) биохимических процессов;
- гормоны – тонкие регуляторы обменных процессов;
- нуклеопротеиды – регулируют синтез белка в организме и являются
носителями наследственной информации.
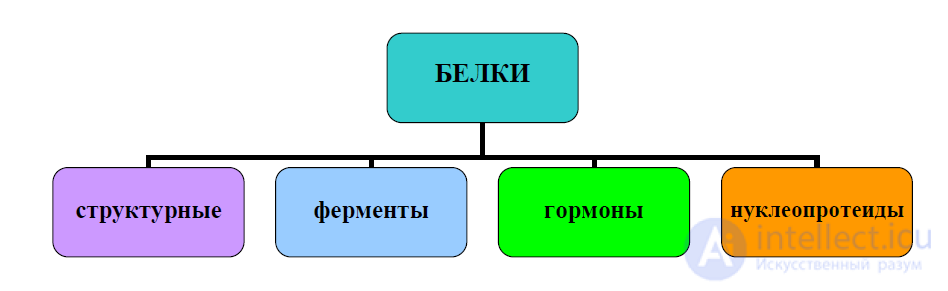
Рисунок 6 – Классификация белков по функциям в организме
Классификация по происхождению. Об этом говорит сайт https://intellect.icu . По происхождению белковые вещества
бывают:
- растительные белки – белки зерновых культур, овощей и т.д.;
- животные белки – белки мяса, молока, яиц и т.д.
2.4 Незаменимые аминокислоты
Общее количество встречающихся в природе аминокислот достигает 200.
Среди них различают:
- аминокислоты, входящие в состав белков (протеиногенные); их
насчитывается 20;
- аминокислоты, не входящие в состав белков (непротеиногенные).
Протеиногенные аминокислоты делятся на:
- заменимые (неэссенциальные) – синтезирующиеся в организме человека, они
способны заменять одна другую в рационе, так как превращаются друг в друга;
- незаменимые (эссенциальные) – они синтезируются только растениями и не
синтезируются в организме человека, они должны доставляться с пищей.
Биологическая ценность белков определяется сбалансированностью
аминокислотного состава по содержанию незаменимых аминокислот. В эту группу
входят аминокислоты, которые не синтезируются в организме человека. К
незаменимым аминокислотам относят аминокислоты: валин, лейцин, изолейцин,
фенилаланин, лизин, треонин, метионин, триптофан. Аминокислоты аргинин и
гистидин являются незаменимыми для детского организма, а для взрослого
организма являются частично незаменимыми.
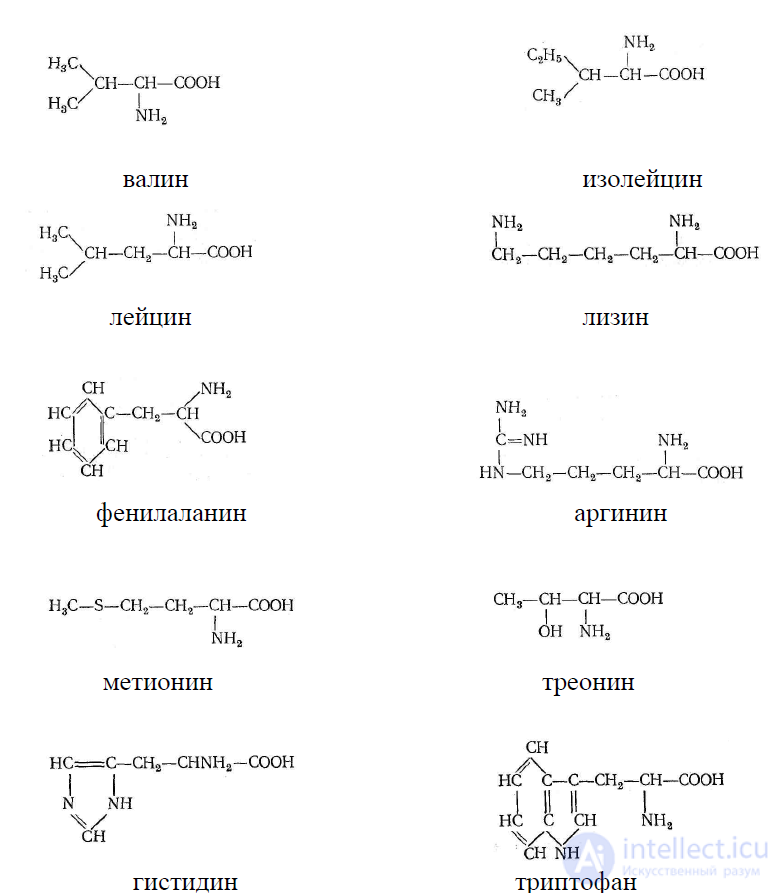
валин изолейцин
лейцин лизин
фенилаланин аргинин
метионин треонин
гистидин триптофан
2.5 Функции и применение аминокислот
Аминокислоты – гетерофункциональные соединения, содержащие две разные
функциональные группы (аминогруппу и карбоксильную группу). Эта особенность
строения и состава придает им ряд функций.
1. Структурная функция – аминокислоты являются структурными
элементами белков.
2. Медиаторная функция – аминокислоты регулируют прохождение нервных
импульсов от клетки к клетке.
3. Буферная функция – аминокислоты являются амфотерными соединениями,
т.е. в зависимости от условий проявляют свойства, как оснований, так и кислот. В
силу амфотерности способны создавать и поддерживать определенное значение рН,
что является важным для поддержания значения рН крови, тканевых жидкостей.
4. Радиопротекторная функция - аминокислота, называемая цистеином,
повышает устойчивость организма к негативному воздействию радиации.
5. Образование меланоидинов. Аминокислоты наряду с белками при
нагревании взаимодействуют с редуцирующими веществами (например,
восстанавливающими углеводами) без участия ферментов. Образуются
азотсодержащие пигменты коричневого цвета, называемые меланоидинами.
Взаимодействие называется реакцией меланоидинообразования (реакция
неферментативного потемнения). Эти вещества образуются при выпечке хлеба,
обжарке кофейных зерен, варке.
6. Образование меланинов. Аминокислота, называемая тирозином, под
действием фермента тирозиназы превращается в пигменты коричневого цвета,
называемые меланинами (реакция ферментативного потемнения). Они
обуславливают окраску волос, кожи, радужной оболочки глаз, темный цвет ржаного
хлеба, потемнение очищенного картофеля.
тирозиназа
тирозин → меланины
7. Лекарственные препараты. Аминокислота глицин – лекарственный
препарат. Применяется для повышения умственной работоспособности, при
стрессовых ситуациях и нарушениях сна, различных заболеваниях нервной системы
(невроз, вегетососудистая дистония, черепно-мозговая травма, ишемический
инсульт, энцефалопатия, в том числе, алкогольного генеза).
8. Пищевые добавки. Соль глутаминовой кислоты – глутамат натрия –
пищевая добавки класса усилителей вкуса и аромата. Эти вещества усиливают
природный вкус и аромат продукта, а так же восстанавливают эти свойства,
ослабленные в процессе хранения продукта или кулинарной обработки. Их вносят
в пищу на этапе технологического процесса или непосредственно в пищу перед ее
употреблением.
2.6 Физиологические функции белков
В организме человека белки выполняют целый ряд разнообразных функций.
1. Структурная функция – белки входят в состав ядра, протоплазмы,
мембран клеток всех органов и тканей.
2. Энергетическая функция – при окислении 1 г белов выделяется 4 ккал или
16,74 кДж энергии.
3. Защитная функция – антитела, образующиеся при поступлении в организм
чужеродных веществ, являются белками.
4. Антитоксическая функция – белки образуют с токсинами малоактивные
комплексы, которые выводятся из организма.
5. Функция воспроизводства живой материи – белки участвуют в процессах
воспроизводства живой материи, входя в состав нуклеопротеидов.
6. Опорная функция – белки входят в состав костей, хрящей, сухожилий.
7. Сократительная функция – белки обеспечивают сокращение мышц.
8. Каталитическая функция – ферменты – это биокатализаторы белковой
природы.
9. Транспортная функция – некоторые белки плазмы крови обеспечивают
перенос питательных веществ.
10. Регуляторная функция – многие гормоны и их производные являются
белками.
11. Функция возбуждения и торможения – белки пищи оказывают влияние на
процессы возбуждения и торможения в коре головного мозга.
12. Функция свертывания крови – процесс свертывания крови, который
протекает с участием белков плазмы, препятствует большим кровопотерям.
2.7 Азотистый баланс
Для изучения потребности организма в белках измеряют азотистый баланс.
Азотистый баланс – это разность между азотом белка, поступившим в организм, и
азотом продуктов распада белка выведенным из организма.
У здорового взрослого человека при полноценном рационе питания
наблюдается азотистое равновесие, т.е. количество азота потребленных белков равно
количеству выведенного из организма азота.
В молодом растущем организме преобладают пластические процессы, идет
накопление мышечной массы, образуются гормоны, ферменты и другие соединения.
Вследствие этого наблюдается положительный азотистый баланс, т. е. азота из
организма выводится меньше, чем поступает с пищей. Так же положительный
азотистый баланс наблюдается в организме беременной женщины.
При недостатке белков в рационе, а также у пожилых и старых людей
азотистый баланс становится отрицательным. Отрицательный азотистый баланс
развивается также при недостатке любого незаменимого нутриента (аминокислот,
витаминов, минеральных веществ), т.е. при несбалансированном питании. При
нарушении усвояемости пищи вследствие некоторых заболеваний азотистый баланс
так же отрицательный. Длительный отрицательный азотистый баланс неизбежно
приводит к летальному исходу.
2.8 Аминокислотный скор
Отсутствие в пище одной или нескольких незаменимых аминокислот
приводит к нарушению деятельности центральной нервной системы, неполному
усвоению других аминокислот, останавливает рост и развитие организма.
Биологическая ценность белков рассчитывается по аминокислотному скору.
Аминокислотный скор выражается в процентах, представляющих
отношение содержания незаменимой аминокислоты в 1 г исследуемого белка к ее
количеству в 1 г эталонного белка.
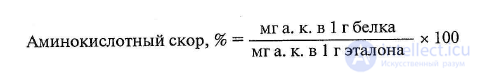
Аминокислотный состав эталонного белка сбалансирован и идеально
соответствует потребностям человека в каждой незаменимой аминокислоте
(таблица 2).
Таблица 2 – Состав идеального белка по шкале ФАО/ВОЗ
Таблица 2 – Состав идеального белка по шкале ФАО/ВОЗ
Название аминокислоты Содержание аминокислоты в
идеальном белке, мг/1 г белка
валин 50
лейцин 70
изолейцин 40
лизин 55
метионин и цистеин 35
треонин 40
триптофан 10
фенилаланин и тирозин 60
Незаменимые аминокислоты, скор которых меньше 100 %, считаются
лимитирующими, т.к. ограничивают биологическую ценность белка.
Лимитирующая аминокислота, скор которой имеет самое низкое значение,
называется первой лимитирующей аминокислотой. Незаменимая аминокислота,
относительное количество которой в данном белке больше, чем первой
лимитирующей, но меньше, чем остальных, называется второй лимитирующей
аминокислотой. Затем идет третья лимитирующая аминокислота и т.д. В белке
пшеницы первой лимитирующей является аминокислота лизин, в кукурузе –
метионин, в картофеле и бобовых культурах лимитирующими являются метионин и
цистеин.
2.9 Превращения белков в ходе технологической обработки
Денатурация. Это процесс изменения нативной пространственной структуры
белка под влиянием внешних факторов: высокие и низкие температуры,
механическое воздействие, химическое воздействие, физическое воздействие и т.д.
При денатурации последовательно разрушаются четвертичная, третичная, вторичная
структуры белка, но сохраняется первичная структура и не изменяется химический
состав белка (рисунок 7). При денатурации меняются физические свойства белка:
снижается растворимость и водосвязывающая способность, теряется биологическая
активность белка. Одновременно увеличивается активность некоторых химических
групп, облегчается ферментативный гидролиз белка. Денатурированные белки
обычно менее растворимы в воде, так как их полипептидные цепи настолько сильно
переплетены между собой, что затрудняется доступ молекул растворителя к радикалам
остатков аминокислот. Процесс денатурации в большинстве случаев необратим.
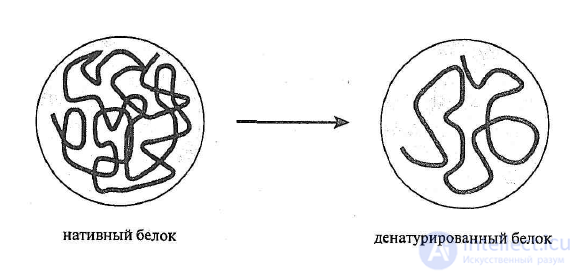
Рисунок 7 – Схема денатурации белковой молекулы
Термическая денатурация белка протекает уже при температуре 60 0С.
Тепловая денатурация белков является одним из основных физико-химических
процессов, лежащих в основе выпечки хлеба, печенья, бисквитов, пирожных, сухарей,
сушки макаронных изделий, получения экструдатов и сухих завтраков, варки, жарения
овощей, рыбы, мяса, консервирования, пастеризации и стерилизации молока. Этот вид
превращений относится к полезным, так как он ускоряет переваривание белков в
желудочно-кишечном тракте человека (облегчая доступ к ним протеолитических
ферментов) и обуславливает потребительские свойства пищевых продуктов (текстуру,
внешний вид, органолептические свойства).
Меланоидинообразование (реакция Майяра). При взаимодействии
аминогрупп белков и аминокислот с карбонильными группами углеводов
происходит реакция меланоидинообразования. Это окислительно-
восстановительный процесс образования различных промежуточных продуктов
(фурфурол, оксиметилфурфурол, уксусный альдегид, изовалериановый альдегид,
диацетил), которые на последующих этапах взаимодействуют между собой и с
исходными веществами. Конечные продукты реакции – меланоидины имеют
коричневый цвет, влияют на цвет и вкус готовых продуктов. Схема реакции
меланоидинообразования выглядит следующим образом:
восстанавливающий углевод + аминокислота →
глюкозамин → меланоидины
Реакция меланоидинообразования происходит при сушке солода, при
кипячении сусла с хмелем в производстве пива, при выпечке хлеба, при варке
сахарных сиропов, при переработке овощей и фруктов. Скорость и глубина реакции
меланоидинообразования зависят от состава продукта, уровня рН среды (более
благоприятны нейтральная и слабощелочная среда), температуры, влажности. На
осуществление реакции меланоидинообразования расходуются ценные питательные
и биологически активные вещества (белки, витамины, аминокислоты, углеводы),
снижается активность витаминов и ферментов, что в целом приводит к снижению
пищевой, энергетической и биологической ценности продуктов.
Ферментативный гидролиз белков. Гидролиз белков осуществляют
протеолитические ферменты, разрушая пептидную связь. Большое разнообразие
протеолитических ферментов связано со специфичностью их воздействия на белок.
Место приложения или действия протеолитического фермента связано со
структурой радикалов, находящихся рядом с пептидной связью. Пепсин расщепляет
связь между фенилаланином и тирозином, глутаминовой кислотой и цистеином
(метионином, глицином), между валином и лейцином. Трипсин расщепляет связь
между аргинином и другими аминокислотами, химотрипсин – между
ароматическими аминокислотами (триптофан, тирозин, фенилаланин) и
метионином. Аминопептидазы действуют со стороны N-концевой аминокислоты,
карбоксипептидазы со стороны С-концевой аминокислоты. Эндопептидазы
разрушают внутренние пептидные связи, экзопептидазы – действуют с конца
молекулы. Для полного гидролиза белковой молекулы необходим набор различных
протеолитических ферментов.
Гидролиз белка под действием эндопептидаз и экзопептидаз можно
представить в виде схемы:
белок → альбумозы → пептоны → полипептиды →
олигопептиды → дипептиды → α-аминокислоты
Контрольные вопросы
1. Что такое белки? Дайте общую характеристику белкам.
2. Чему равна энергетическая ценность белков?
3. Назовите суточную потребность организма человека в белках.
4. Охарактеризуйте пространственные структуры белков: первичную,
вторичную, третичную, четвертичную.
5. Каковы природа и роль химических связей в организации пространственной
структуры белков?
6. Каковы отличительные особенности вторичной структуры белка в форме
спирали и складчатого слоя?
7. Каковы отличительные особенности третичной структуры белка в форме
глобулы и фибриллы?
8. Что лежит в основе классификаций белков? Какие классификации белков
вам известны?
9. На какие группы делятся белки по происхождению? Приведете примеры.
10. На какие группы делятся белки по форме молекул? Приведете примеры.
11. На какие группы делятся белки по строению и составу? Приведете
примеры.
12. Охарактеризуйте простые белки.
13. Какие белки относятся к сложным? Приведите примеры сложных белков.
14. На какие группы делятся белки по растворимости? Приведете примеры.
15. На какие группы делятся белки по функциям в организме? Приведете
примеры.
16. Охарактеризуйте структурные белки.
17. Охарактеризуйте гормоны.
18. Охарактеризуйте ферменты.
19. Охарактеризуйте нуклеопротеиды.
20. Что такое протеиногенные аминокислоты?
21. Какие аминокислоты называются незаменимыми? Перечислите их.
22. Перечислите функции и области применения аминокислот.
23. Сформулируйте физиологические функции белков.
24. Что такое азотистый баланс? Перечислите виды азотистого баланса.
25. Что такое аминокислотный скор?
26. Что такое лимитирующая аминокислота? Что такое первая лимитирующая
аминокислота?
27. Что такое денатурация белков? Какие факторы вызывают денатурацию
белков?
28. Поясните, что такое реакция Майяра. Какое значение в производстве
продуктов она имеет?
29. Расскажите о процессе ферментативного гидролиза белка.
30. Перечислите промежуточные продукты гидролиза белка.
31. Как называются ферменты, ускоряющие гидролиз белка?
Исследование, описанное в статье про 2 Аминокислоты и белки, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое 2 Аминокислоты и белки и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Пищевая химия
Ответы на вопросы для самопроверки пишите в комментариях, мы проверим, или же задавайте свой вопрос по данной теме.
Комментарии
Оставить комментарий
Пищевая химия
Термины: Пищевая химия