Лекция
Привет, Вы узнаете о том , что такое химическая связь , Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое химическая связь , настоятельно рекомендую прочитать все из категории Материаловедение и материалы электронных аппаратов.
При рассмотрении химических связей в материалах основными элементарными частицами являются протоны, нейтроны и электроны.
Атомные ядра состоят из протонов и нейтронов; электроны располагаются на разрешенных оболочках вокруг ядра, компенсируя его заряд.
Атом водорода состоит из одного протона и одного электрона. В классическом представлении (планетарной модели) электрон вращается по орбите вокруг ядра (рис. 1.2, а). В квантовой механике движение электрона описывается волновой функцией, обладающей сферической симметрией, так что распределение заряда электрона образует размытое облако (рис. 1.2, б). В молекуле водорода (рис. 1.2, в) ядра атомов располагаются на расстоянии 0,74 Å. Радиус электронного облака одного атома составляет примерно 1 Å.
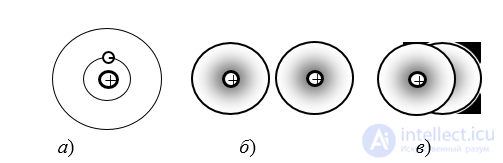
а) б) в)
Рис. 1.2. Структура атома и молекулы водорода:
а – простейшая модель атома водорода в классическом представлении (внешняя орбита разрешенная, но не заполненная в невозбужденном состоянии атома); б – модель атомов водорода, удаленных друг от друга в квантовомеханическом представлении; в – молекула водорода (градиентной штриховкой показана плотность заряда электрона)
В атоме разрешенными для электронов орбитами являются только те, на длине которых (2πr) укладывается целое число длин волн Де-Бройля λ:
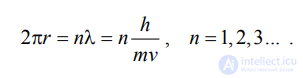
Исходя из этого постулата, определим радиус стационарных орбит и соответствующие им энергетические уровни электронов :
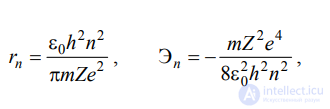
где ε0 = 8,85⋅10−12  Фм – диэлектрическая постоянная; Z – заряд ядра.
Фм – диэлектрическая постоянная; Z – заряд ядра.
Атомы, ионы, молекулы. Газы, жидкости и твердые тела могут состоять из атомов, молекул или ионов. Об этом говорит сайт https://intellect.icu . Размеры атомов порядка одного или нескольких ангстрем (1 Å = 10–10 м), размеры положительных ионов – атомов, лишенных части электронов, меньше размеров атомов, и размеры отрицательных ионов, присоединивших дополнительные электроны, больше размеров соответствующих атомов.
При достаточном сближении частиц между ними возникают силы взаимодействия. Независимо от природы этих сил общий характер их остается одинаковым (рис. 1.3): на относительно больших расстояниях возникают силы притяжения Fпр, увеличивающиеся с уменьшением расстояния между частицами r (кривая 1); на небольших расстояниях возникают силы отталкивания Fот, которые с уменьшением r увеличиваются значительно быстрее, чем Fпр (кривая 3). На расстоянии r = r0 силы отталкивания уравновешивают силы притяжения, и результирующая сила F обращается в нуль (кривая 2). Различают несколько видов химической связи.
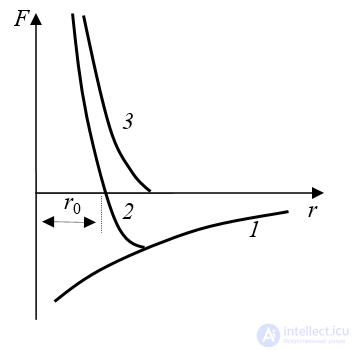
Рис. 1.3. Зависимость силы взаимодействия атомов от расстояния между ними
Гомеополярная (ковалентная) связь. При этой связи у веществ объединение атомов в молекулу достигается за счет электронов, которые становятся общими для пар атомов. Плотность отрицательно заряженного облака между положительными ядрами является наибольшей, например молекула водорода на рис. 1.2, в. Такую связь называют гомеополярной или ковалентной. Появление состояния с повышенной плотностью электронного заряда в межъядерном пространстве и приводит к возникновению сил притяжения.
Молекулы с гомеополярной связью бывают неполярными или полярными (дипольными) в соответствии с симметричным или асимметричным строением (рис. 1.4).
Гомеополярная связь типична для органических молекул. Вместе с тем она может наблюдаться и у твердых веществ неорганического происхождения, если их кристаллические решетки состоят из атомов. Примерами подобных веществ являются алмаз, кремний, германий, карбид кремния (SiC) и др.
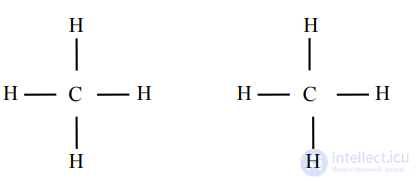
Рис. 1.4. Примеры неполярной (слева) и полярной (справа) молекул
Ковалентная связь характеризуется высокой прочностью. Подтверждением этому является высокая твердость и высокая температура плавления.
Гетерополярная (ионная) связь возникает вследствие перехода валентных электронов от металлического атома к металлоидному, что является причиной электростатического притяжения разноименно заряженных ионов друг к другу. Этот вид связи существует в ионных кристаллах. Типичным примером ионных кристаллов являются галоидные соли щелочных металлов.
Наименьшей электроотрицательностью обладают атомы щелочных металлов, которые легко отдают электрон и отличаются малой энергией сродства к электрону. Наоборот, наибольшую электроотрицательность имеют атомы галогенов, которые охотно принимают электрон для завершения внешней электронной оболочки.
 Металлическая связь существует в системах, построенных из положительных ионов, находящихся среди свободных коллективизированных электронов. Металлическую связь Молекула 1 можно рассматривать до некоторой степени как ковалентную, поскольку в основе ее лежит обобществление внешних валентных электронов. Специфика металлической связи состоит в том, что в обобществлении электронов участвуют все атомы кристалла, и обобществленные электроны не локализуются вблизи своих атомов, а свободно перемещаются внутри всей решетки, образуя «электронный газ». Не имея локализованных связей, металлические Молекула 2 кристаллы (в отличие от ионных) не разрушаются при изменении положений атомов, т.е. им свойственна пластичность при деформациях. Благодаря наличию свободных электронов
Металлическая связь существует в системах, построенных из положительных ионов, находящихся среди свободных коллективизированных электронов. Металлическую связь Молекула 1 можно рассматривать до некоторой степени как ковалентную, поскольку в основе ее лежит обобществление внешних валентных электронов. Специфика металлической связи состоит в том, что в обобществлении электронов участвуют все атомы кристалла, и обобществленные электроны не локализуются вблизи своих атомов, а свободно перемещаются внутри всей решетки, образуя «электронный газ». Не имея локализованных связей, металлические Молекула 2 кристаллы (в отличие от ионных) не разрушаются при изменении положений атомов, т.е. им свойственна пластичность при деформациях. Благодаря наличию свободных электронов
металлы обладают высокой электро- и теплопроводностью.
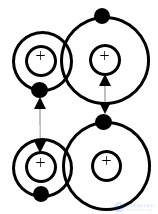
Молекулярная связь, или связь Ван-дер-Ваальса, наблюдается у ряда веществ между молекулами с ковалентными связями. Наличие межмолекулярного притяжения в этом случае возможно при согласованном движении валентных электронов в соседних молекулах (рис. 1.5). В любой момент времени электроны должны быть максимально удалены друг от друга и максимально приближены к положительным зарядам (ядрам). Связь Ван-дер-Ваальса является наиболее универсальной, она возникает между любыми частицами, но это наиболее слабая связь, энергия ее примерно на два порядка ниже энергии ионной и ковалентной связей. Молекулярная связь легко разрушается тепловым движением. Поэтому молекулярные кристаллы обладают низкими температурами плавления (например, у парафина температура плавления составляет 50 … 52°С).
Данная статья про химическая связь подтверждают значимость применения современных методик для изучения данных проблем. Надеюсь, что теперь ты понял что такое химическая связь и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Материаловедение и материалы электронных аппаратов
Из статьи мы узнали кратко, но содержательно про химическая связь
Комментарии
Оставить комментарий
Материаловедение и материалы электронных аппаратов
Термины: Материаловедение и материалы электронных аппаратов