Лекция
Это продолжение увлекательной статьи про кристаллическая структура.
...
скольжения , которые отражают точку через плоскость, переводя ее параллельно плоскости.
Есть 230 различных космических групп.
Рассматривая расположение атомов относительно друг друга, их координационные числа (или количество ближайших соседей), межатомные расстояния, типы связи и т. Д., Можно сформировать общее представление о структурах и альтернативных способах их визуализации.
Используемые принципы можно понять, рассмотрев наиболее эффективный способ упаковки сфер одинакового размера и укладки плотно упакованных атомных плоскостей в трех измерениях. Например, если плоскость A лежит ниже плоскости B, есть два возможных способа размещения дополнительного атома поверх слоя B. Если дополнительный слой был помещен непосредственно над плоскостью A, это привело бы к следующей серии:
... АБАБАБАБ ...
Такое расположение атомов в кристаллической структуре известно как гексагональная плотная упаковка (ГПУ) .
Если, однако, все три плоскости расположены в шахматном порядке относительно друг друга и последовательность повторяется только после того, как четвертый слой будет расположен непосредственно над плоскостью A, тогда возникает следующая последовательность:
... ABCABCABC ...
Этот тип структурного устройства известен как кубическая плотная упаковка (ccp) .
Элементарной ячейкой ccp-расположения атомов является гранецентрированная кубическая (ГЦК) элементарная ячейка. Это не сразу очевидно, поскольку плотно упакованные слои параллельны плоскостям {111} элементарной ГЦК-ячейки. Есть четыре различных ориентации плотноупакованных слоев.
Эффективность упаковки может быть разработана путем расчета общего объема сфер и деления на объеме ячейки следующим образом :
Эффективность упаковки 74% - это максимальная плотность, возможная для элементарных ячеек, построенных из сфер только одного размера. Большинство кристаллических форм металлических элементов - это ГПУ, ГЦК или ОЦК (объемно-центрированная кубическая). Координационное число атомов в ГПУ и ГЦК структуры 12 и ее атомный фактор упаковки (ПФ) это число упоминалось выше, 0,74. Это можно сравнить с APF для ОЦК-структуры, которое составляет 0,68.
Границы зерен - это границы раздела, на которых встречаются кристаллы разной ориентации. граница зерна представляет собой однофазный интерфейс, с кристаллами на каждой стороне границы являются идентичными , за исключением ориентации. Иногда, хотя и редко, используется термин «граница кристаллита». Области границ зерен содержат те атомы, которые были возмущены из своих исходных узлов решетки, дислокации и примеси, которые мигрировали к границе зерен с более низкой энергией.
Рассматривая границу зерен геометрически как поверхность раздела монокристалла, разрезанного на две части, одна из которых вращается, мы видим, что для определения границы зерен требуется пять переменных. Первые два числа берутся из единичного вектора, определяющего ось вращения. Третье число обозначает угол поворота зерна. Последние два числа определяют плоскость границы зерна (или единичный вектор, перпендикулярный этой плоскости).
Границы зерен нарушают движение дислокаций через материал, поэтому уменьшение размера кристаллитов является обычным способом повышения прочности, как описано соотношением Холла – Петча . Поскольку границы зерен являются дефектами кристаллической структуры, они имеют тенденцию уменьшать электрическую и теплопроводность материала. Высокая межфазная энергия и относительно слабая связь в большинстве границ зерен часто делают их предпочтительными участками для начала коррозии и выделения новых фаз из твердого тела. Они также важны для многих механизмов ползучести .
Границы зерен обычно имеют ширину всего несколько нанометров. В обычных материалах кристаллиты достаточно велики, чтобы границы зерен составляли небольшую часть материала. Однако достижимы очень маленькие размеры зерен. В нанокристаллических твердых телах границы зерен составляют значительную объемную долю материала, что оказывает сильное влияние на такие свойства, как диффузия и пластичность . В пределе мелких кристаллитов, когда объемная доля границ зерен приближается к 100%, материал перестает иметь какой-либо кристаллический характер и, таким образом, становится аморфным твердым телом .
Реальные кристаллы имеют дефекты или неровности в идеальном устройстве, описанном выше, и именно эти дефекты критически определяют многие электрические и механические свойства реальных материалов. Когда один атом замещает один из основных атомных компонентов в кристаллической структуре, могут произойти изменения электрических и тепловых свойств материала. [10] Примеси могут также проявляться как примеси электронного спина в некоторых материалах. Исследования магнитных примесей показывают, что на существенное изменение определенных свойств, таких как удельная теплоемкость, могут влиять небольшие концентрации примеси, например, примесей в полупроводниковых ферромагнитных сплавах.может привести к другим свойствам, как впервые было предсказано в конце 1960-х годов. Дислокации в кристаллической решетке допускают сдвиг при меньшем напряжении, чем это необходимо для идеальной кристаллической структуры.
Сложность предсказания стабильных кристаллических структур на основе знания только химического состава долгое время была камнем преткновения на пути к полностью вычислительному дизайну материалов. Теперь, благодаря более мощным алгоритмам и высокопроизводительным вычислениям, структуры средней сложности могут быть предсказаны с использованием таких подходов, как эволюционные алгоритмы , случайная выборка или метадинамика.
Кристаллические структуры простых ионных твердых веществ (например, NaCl или поваренная соль) уже давно рационализированы в терминах правил Полинга , впервые изложенных в 1929 году Линусом Полингом , которого многие с тех пор называют «отцом химической связи». [14]Полинг также рассмотрел природу межатомных сил в металлах и пришел к выводу, что около половины из пяти d-орбиталей в переходных металлах участвуют в связывании, а оставшиеся несвязывающие d-орбитали ответственны за магнитные свойства. Таким образом, он смог соотнести количество d-орбиталей в образовании связи с длиной связи, а также со многими физическими свойствами вещества. Впоследствии он ввел металлическую орбиталь, дополнительную орбиталь, необходимую для разрешения неограниченного резонанса валентных связей между различными электронными структурами. [15]
В теории резонансных валентных связей факторы, определяющие выбор одной из альтернативных кристаллических структур металла или интерметаллического соединения, вращаются вокруг энергии резонанса связей между межатомными положениями. Ясно, что некоторые режимы резонанса будут давать больший вклад (будут более механически устойчивыми, чем другие), и что, в частности, простое соотношение количества связей к количеству позиций будет исключительным. Результирующий принцип заключается в том, что особая стабильность связана с простейшими соотношениями или «числами облигаций»: 1 ⁄ 2 , 1 ⁄ 3 , 2 ⁄ 3 , 1 ⁄ 4 , 3.⁄ 4 и т. Д. Выбор структуры и значение осевого отношения (которое определяет относительную длину связи), таким образом, является результатом попытки атома использовать свою валентность для образования стабильных связей с простыми дробными числами связей. [16] [17]
Постулируя прямую корреляцию между концентрацией электронов и кристаллической структурой в сплавах с бета-фазой, Хьюм-Розери проанализировал тенденции изменения точек плавления, сжимаемости и длин связей в зависимости от номера группы в периодической таблице, чтобы установить систему валентностей переходные элементы в металлическом состоянии. Таким образом, эта обработка подчеркнула увеличение прочности сцепления в зависимости от номера группы. [18]Действие направленных сил было подчеркнуто в одной статье о связи между связующими гибридами и металлическими структурами. Результирующая корреляция между электронными и кристаллическими структурами резюмируется одним параметром, весом d-электронов на гибридизованную металлическую орбиталь. «D-вес» составляет 0,5, 0,7 и 0,9 для структур ГЦК, ГПУ и ОЦК соответственно. Таким образом, становится очевидной связь между d-электронами и кристаллической структурой. [19]
При прогнозировании / моделировании кристаллической структуры обычно применяется периодичность, поскольку система представляется неограниченно большой во всех направлениях. Начиная с триклинной структуры без дополнительных предполагаемых свойств симметрии, систему можно заставить показать некоторые дополнительные свойства симметрии, применив Второй закон Ньютона к частицам в элементарной ячейке и недавно разработанное динамическое уравнение для векторов периодов системы [20] (решетка параметры, включая углы), даже если система подвергается внешнему воздействию.
Полиморфизм - это появление нескольких кристаллических форм материала. Он содержится во многих кристаллических материалах, включая полимеры , минералы и металлы . Согласно правилам фазового равновесия Гиббса, эти уникальные кристаллические фазы зависят от интенсивных переменных, таких как давление и температура. Полиморфизм связан с аллотропией , которая относится к элементарным твердым телам . Полная морфология материала описывается полиморфизмом и другими переменными, такими как габитус кристалла , аморфная фракция или кристаллографические дефекты.. Полиморфы обладают разной стабильностью и могут спонтанно и необратимо превращаться из метастабильной формы (или термодинамически нестабильной формы) в стабильную форму при определенной температуре. [21] Они также имеют разные температуры плавления , растворимость и дифрактограммы рентгеновских лучей .
Хорошим примером этого является кварцевая форма диоксида кремния или SiO 2 . В подавляющем большинстве силикатов атом Si имеет тетраэдрическую координацию по 4 атомам кислорода. Все кристаллические формы, кроме одной, содержат тетраэдрические {SiO 4} блоки, соединенные вместе общими вершинами в разном порядке. В разных минералах тетраэдры демонстрируют разную степень сетки и полимеризации. Например, они встречаются поодиночке, соединены вместе попарно, в более крупные конечные кластеры, включая кольца, цепочки, двойные цепи, листы и трехмерные каркасы. Минералы классифицируются на группы на основе этих структур. В каждой из 7 термодинамически стабильных кристаллических форм или полиморфов кристаллического кварца только 2 из 4 ребер тетраэдров {SiO 4 } являются общими с другими, что дает чистую химическую формулу кремнезема: SiO 2 .
Другой пример - элементарное олово (Sn), которое является пластичным при температурах окружающей среды, но хрупким при охлаждении. Это изменение механических свойств связано с существованием двух его основных аллотропов , α- и β-олова. Два аллотропа , которые встречаются при нормальном давлении и температуре, α-олово и β-олово, более известны как серое олово и белое олово соответственно. Еще два аллотропа, γ и σ, существуют при температурах выше 161 ° C и давлениях выше нескольких ГПа. [22] Белое олово является металлическим и является стабильной кристаллической формой при комнатной температуре или выше. Ниже 13,2 ° C олово существует в серой форме, которая имеет кубическую форму алмаза.кристаллическая структура, подобная алмазу , кремнию или германию . Серое олово вообще не имеет металлических свойств, представляет собой тускло-серый порошкообразный материал и имеет несколько применений, кроме нескольких специализированных полупроводниковых применений. [23] Хотя температура α – β превращения олова номинально составляет 13,2 ° C, примеси (например, Al, Zn и т. Д.) Понижают температуру перехода значительно ниже 0 ° C, и при добавлении Sb или Bi превращение может не происходить. вообще. [24]
Двадцать из 32 классов кристаллов являются пьезоэлектрическими , и кристаллы, принадлежащие к одному из этих классов (точечных групп), проявляют пьезоэлектричество . Все классы пьезоэлектрических элементов не обладают инверсионной симметрией . Любой материал развивает диэлектрическую поляризацию при приложении электрического поля, но вещество, которое имеет такое естественное разделение зарядов даже в отсутствие поля, называется полярным материалом. Полярность материала определяется исключительно его кристаллической структурой. Только 10 из 32 точечных групп полярны . Все полярные кристаллы являются пироэлектрическими , поэтому 10 классов полярных кристаллов иногда называют пироэлектрическими классами.
Есть несколько кристаллических структур, особенно структура перовскита , которые демонстрируют сегнетоэлектрические свойства. Это аналогично ферромагнетизму в том смысле , что в отсутствие электрического поля во время производства сегнетоэлектрический кристалл не проявляет поляризации. При приложении электрического поля достаточной величины кристалл становится постоянно поляризованным. Эта поляризация может быть обращена достаточно большим противодействием, точно так же, как ферромагнетик может быть перевернут. Однако, хотя они и называются сегнетоэлектриками, эффект обусловлен кристаллической структурой (а не наличием черного металла).
Наиболее надежную и всестороннюю информацию о структуре удается получать для веществ в кристаллическом состоянии. Использование рентгеноструктурного анализа кристаллов (иногда в сочетании с нейтронографией) [2, 3] позволяет конструировать модели разного типа и разного уровня (табл. 1). На примере кристаллических [структур (полученные к настоящему времени сведения о кристаллических структурах аккумулируются в базах данных. Более 100 тыс. структур органических соединений и координационных соединений с органическими лигандами представлены в Кембриджской базе структурных данных (CSD), координаты атомов в десятках тысяч неорганических структур содержатся в базе данных информационного центра FIZ в Карлсруэ (ICSD), структурная информация для без малого тысячи белков, энзимов, вирусов, полинуклеотидов и углеводов собрана в Брукхевенской базе данных (PDB).) удобно рассмотреть важнейшие способы моделирования пространственного строения вещества, базирующиеся на экспериментальных данных .
Главным результатом обычного (стандартного) ренттеноструктурного анализа являются следующие величины: параметры элементарной ячейки а, b, с, ,  ,
, 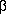 ,
, 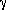 , характеризующие базис решетки {L}, и координаты атомов или радиус векторы ri, описывающие расположение атомов в ячейке. Указанная информация представляет собой так называемую r-модель, в которой каждый атом обозначен точкой, эта точка с точностью -0,01 А соответствует среднему во времени положению ядра (за исключением атомов водорода, для которых расхождение может быть существенно больше).
, характеризующие базис решетки {L}, и координаты атомов или радиус векторы ri, описывающие расположение атомов в ячейке. Указанная информация представляет собой так называемую r-модель, в которой каждый атом обозначен точкой, эта точка с точностью -0,01 А соответствует среднему во времени положению ядра (за исключением атомов водорода, для которых расхождение может быть существенно больше).
Однако достаточную наглядность модель кристаллической структуры приобретает лишь в результате "первичной трактовки" (или "первичной интерпретации"). При наличии ковалентных связей соответствующие атомы
Таблица 1. Моделирование кристаллической структуры
| Тип модели | Первичная трактовка | Описание | Обозначения |
| r - модель точечная |
{L} = {ri}+F |
r -радиус-вектор i-г атома (ядра), r=r(x,y,z) {L} - базис решетки N - число томов в ячейке k - фактор симметрии F - пространственная группа ij - индексы связанных атомов 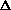 rij = |ri - rj| - (Ri + Rj), где Ri и Rj кристаллохимические радиусы rij = |ri - rj| - (Ri + Rj), где Ri и Rj кристаллохимические радиусы{Ukli} - компоненты тензоров среднеквадратичных смещений атомов 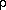 (r) - электронная плотность (r) - электронная плотность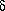 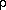 (r) - деформационная электронная плотность (r) - деформационная электронная плотность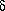 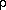 (r) = (r) = 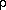 - - 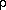 0, где 0, где 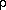 0 - электронная плотность сферически симметричных атомов 0 - электронная плотность сферически симметричных атомов |
|
| r' -модель 1)точечно-штриховая (граф) 2)упаковка |
химические связи
|
+ {ij}
{ |
|
| r, U - модель | тепловые эллипсоиды | + {Ukli} | |
r, 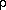 - модель - модель |
топологический анализ | + 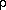 (r) (r) |
|
r, 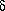 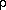 - модель - модель |
электронные пары, перенос заряда, поляризация |
+ 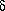 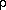 (r) (r) |
соединяются "валентными штрихами", и это дает граф кристаллического вещества. Этот граф необязательно является связным: он может состоять из подграфов, изображающих молекулы, цепи, слои. Вопрос о том, какие атомы следует считать ковалентно связанными, обычно решается путем анализа межатомных расстояний, что приводит к r'-модели, чаще всего удовлет ворительно согласующейся с эмпирическими представлениями классической теории химического строения. Но возникает, естественно, необходимость более глубокого обоснования системы химических связей; для этого используют анализ распределений электронной плотности (см. ниже).
Другой полезный способ построения r'-модели основан на использовании кристаллохимических радиусов; в этом варианте кристаллическая структура изображается в виде упаковки шаров (для ионных и металлических кристаллов ), объемных моделей молекул (для молекулярных кристаллов ), объемных моделей цепей или слоев (для цепочечных и слоистых кристаллов).
Следующий шаг в моделировании кристаллических структур состоит в учете теплового движения атомов. В гармоническом приближении это можно сделать с помощью r, U-модели, в которой каждый атом представлен в виде так называемого "теплового эллипсоида" (рис. 4a)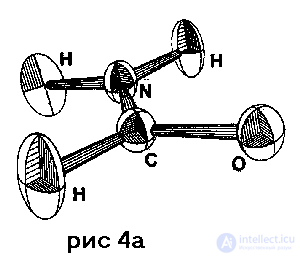 . Здесь используются компоненты тензора второго ранга, выражающего среднеквадратичные смешения атомов и получаемого на этапе уточнения кристаллической структуры по данным рентгеноструктурного исследования. Однако достаточно точные значения величин Uikl (см. табл. 1) получаются лишь при низких температурах и с помощью прецизионного рентгеноструктурного анализа . На базе прецизионной рентгенографии для простейших структур удается учесть ангармонизм тепловых колебаний атомов.
. Здесь используются компоненты тензора второго ранга, выражающего среднеквадратичные смешения атомов и получаемого на этапе уточнения кристаллической структуры по данным рентгеноструктурного исследования. Однако достаточно точные значения величин Uikl (см. табл. 1) получаются лишь при низких температурах и с помощью прецизионного рентгеноструктурного анализа . На базе прецизионной рентгенографии для простейших структур удается учесть ангармонизм тепловых колебаний атомов.
Главное преимущество прецизионного рентгеноструктурного анализа заключается в том, что он дает возможность физически корректно построить непрерывное пространственное распределение электронной плотности р(r) . Уже в первые десятилетия своего существования (в 20 – 30-ые гг.) рентгеноструктурный анализ давал возможность вычислить функцию р(х, у, z), что активно используется и сейчас в рутинном ренттеноструктурном анализе. Но эта функция строится в предположении сферической симметрии атомного рассеяния и поэтому истинным распределением электронной плотности в межьядерном пространстве не является. Из нее можно извлечь лишь приблизительные значения средних координат ядер. Если же для построения пространственного распределения р(r) используются данные прецизионного рентгено структурного анализа и характеристики атомного рассеяния уточняются в ходе исследования, становится доступной r, 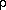 -модель кристаллической структуры, а также особенно наглядная континуальная r,
-модель кристаллической структуры, а также особенно наглядная континуальная r, 
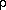 -модель (см. табл. 1), изображающая перераспределение электронной плотности вследствие межатомноro взаимодействия. Интерпретация этих способов моделирования структуры обсуждается ниже. На рис. 4 б и в в качестве примера представлены сечения деформационной электронной плотности в кристаллическом форма миде .
-модель (см. табл. 1), изображающая перераспределение электронной плотности вследствие межатомноro взаимодействия. Интерпретация этих способов моделирования структуры обсуждается ниже. На рис. 4 б и в в качестве примера представлены сечения деформационной электронной плотности в кристаллическом форма миде .
При более общем подходе к структуре вещества следует выделить два уровня ее описа ния: локальный (L) и тотальный (Т). Примени тельно к кристаллической структуре локальные характеристики относятся к отдельным связям, к окружению отдельных атомов. Тотальное описание характеризует структуру в целом – расположение атомов в элементарной ячейке и пространственный узор (pattern), возникающий при сочленении ячеек. Если кристалл состоит из молекул, то к локальному уровню можно отнести описание молекулы, а к тотальному – описание пространственного расположения молекул. Часто полезным оказывается еще и промежуточный уровень (I), который подразумевает описание более или менее крупных частей структуры, выходящих за рамки локального уровня, но не характеризующих строение вещества во всей его пространственной протяженности (это могут быть, в частности, упоминавшиеся выше наноструктуры). Кроме того, как уже было сказано, модель структуры может быть не только статической, но и динамической, если включить в нее описание колебательного движения атомов (или атомных ядер) и иные виды подвижности.
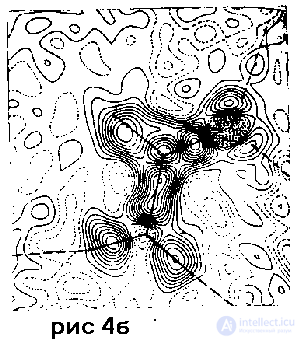 Риc. 4. Результаты прецизионного рентгеноcтруктурного анализа кристалического формамида H2N – СНО при 90 К (по данным работы ):
Риc. 4. Результаты прецизионного рентгеноcтруктурного анализа кристалического формамида H2N – СНО при 90 К (по данным работы ):
а – тепловые эллипсоиды; с вероятностью 0,5 в любой момент времени ядро атома находится внутри такого эллипсоида; направления, в которых эллип соиды вытянуты, соответствуют максимальным сме щениям, а направления, в которых они сжаты, минимальным смещениям в процессе тепловых ко лебаний;
б – деформационная электронная плотность; пока зано сечение, проведенное через плоскость молеку лы; видны максимумы, располагающиеся на связях, – они соответствуют валентным электронным парам – и максимумы, соответствующие неподеленным электронным парам атома О;
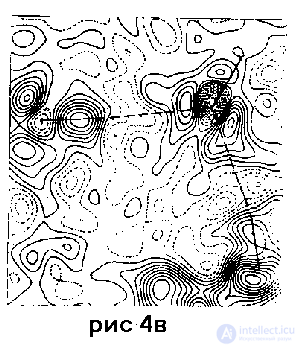 в – деформационная электронная плотность в об ласти межмолекулярных водородных связей; показано сечение, проведенное через плоскость O'...NH2...О"; на линиях NH...О располагаются максимумы, соответствующие валентным парам связей N – H и неподеленным парам атома О
в – деформационная электронная плотность в об ласти межмолекулярных водородных связей; показано сечение, проведенное через плоскость O'...NH2...О"; на линиях NH...О располагаются максимумы, соответствующие валентным парам связей N – H и неподеленным парам атома О
Другая сторона моделирования пространственного строения вещества заключается в том, что описание структуры осуществляется либо на уровне абстрактных канонизированных образов (стереотипов), либо с помощью конкретных геометрических параметров (указываются их численные значения).
В первом случае описание называется топологическим ( полезно обратить внимание на то, что в структурной химии содержание термина "топология" лишь частично совпадает с его математической трактовкой). Яркий пример – структурная формула молекулы (на языке математики это – граф); сюда относятся и конформационные типы (циклогексан в форме "кресла" и в форме "ванны"), и типы координационных полиэдров (тетраэдры, октаэдры и т.п.). Важную роль в характеристике стереотипов играет симметрия. Во втором случае речь идет о количественном описании структуры. И топологическое, и геометрическое описание может относиться как к неподвижной (статической) модели, так и к подвижному обьекту.
Таким образом, выделяются четыре аспекта моделирования структуры: топология в статике, топология в динамике, геометрия в статике и геометрия в динамике. Калдый из этих аспектов строения данного обьекта можно рассмотреть на локальном, промежуточном и тотальном уровнях.
Представленный подход в принципе применим к описанию самых разнообразных атомно-молекулярных систем. В табл. 2 в качестве важнейшего примера дана схема моделирования структуры молекулы.
Таблица 2. Моделироваиие структуры молекулы
| Тип модели | Абстрактные модели | Конкретные (геометрические) модели | |
| общее описание | локальные характеристики | ||
| Статические модели |
Структурная формула (граф)
Электронная структура (орбитали) |
Конформация (дискретная модель) Электронная плотность |
Межъядерные расстояния, валентные и торсионные углы Детали распределения электронной плотности |
| Динамические модели | Моды нормальных молекулярных колебаний | Уравнения внутримолекулярных колебаний
|
Частоты связей, среднеквадра тичные смещения атомов |
При топологическом описании структуры прежде всего фиксируется последовательность соединения атомов – структурная формула. Электронная структура может быть представлена, например, на языке орбитальной концепции химических связей (метод молекулярных орбиталей). Градиентный анализ континуального распределения электронной плотности р(r), подробно рассмотренный ниже, также дает топологические характеристики, качественно описывающие особенности этой функции. Вместе с тем, можно получить и количественные характеристики отдельных участков р(r), в частности тех, где локализуются химические связи.
Динамическая модель включает в себя описание колебательного движения атомов (точнее, атомных ядер). Это описание в свою очередь может быть абстрактным (например, выявление типов так называемых "нормальных" колебаний и их классификация) и конкретным (периодическое изменение геометрических параметров во времени). Кроме того, иногда необходимо описать специфические внутримолекулярные движения (внутреннее вращение, миграцию протона и др.). При этом, как уже было сказано, описание осуществляется на разных уровнях (L., I, Т). Локальные характеристики относятся к отдельным связям, к окружению отдельных атомов. Промежуточный уровень может быть представлен признаками, свойственными каким-либо частям молекулы (в статике – это, например, их конформация, в динамике – описание либрационного движения). Наконец, общее (тотальное) описание характеризует строение молекулы в целом. В идеале желательно создать модель, которая содержит всю информацию, заключенную в этой схеме. Но в действительности почти всегда имеющийся экспериментальный или расчетный материал позволяет обсуждать лишь некоторые структурные характеристики.
Для описания структуры молекулярной жидкости можно иметь в виду информацию, представленную в табл. 3, причем все характеристики, содержащиеся в этой таблице, вообще говоря, желательно рассмотреть и в статике, и в динамике.
Надо сказать, что жидкости (и тем более жидкие растворы) в отношении полного, всестороннего структурного описания представляют собой обьекты чрезвычайной сложности, намного более сложные, чем другие конденсированные фазы. Причина этого состоит не в отсутствии подходящего экспериментального метода, как иногда говорят, а в самой природе жидкого состояния. Структура жидкости постоянно меняется во времени и это изменение отнюдь не является периодическим. Описание такой системы в динамике настолько затруднительно само по себе, что пока не приходится и думать о создании адекватного этой задаче экспериментального метода. Единственным способом получения подобной информации в настоящее время оказывается компьютерное моделирование.
Таблица 3. Элементы структуры конденсированной фазы
| Уровень описания | Топология | Геометрия |
| L.-уровень | Координация атомов, конформация молекул | Межатомные расстояния, валентные и торсионные углы |
| I-уровень | Наличие и строение ассоциатов (агломератов) молекул | Межмолекулярные контакты. Расстояния и углы, характеризующие относительное расположение молекул в ассоциатах |
продолжение следует...
Часть 1 Кристаллическая структура и решетка, ее моделирование, Дефекты кристалла
Часть 2 Атомная координация - Кристаллическая структура и решетка, ее моделирование, Дефекты
Часть 3 Пузырьковая модель кристалла - Кристаллическая структура и решетка, ее моделирование,
Часть 4 - Кристаллическая структура и решетка, ее моделирование, Дефекты кристалла
Исследование, описанное в статье про кристаллическая структура, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое кристаллическая структура, кристаллическая решетка, дефекты кристалла и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Материаловедение и материалы электронных аппаратов
Комментарии
Оставить комментарий
Материаловедение и материалы электронных аппаратов
Термины: Материаловедение и материалы электронных аппаратов