Лекция
Привет, сегодня поговорим про химический источник тока, обещаю рассказать все что знаю. Для того чтобы лучше понимать что такое химический источник тока , настоятельно рекомендую прочитать все из категории Источники питания радиоэлектронной аппаратуры.
Хими́ческий исто́чник то́ка (аббр. ХИТ) — источник ЭДС, в котором энергия протекающих в нем химических реакций непосредственно превращается в электрическую энергию.
Первый химический источник тока был изобретен итальянским ученым Алессандро Вольта в 1800 году. Это был «элемент Вольта» — сосуд с соленой водой с опущенными в него цинковой и медной пластинками, соединенными проволокой. Затем ученый собрал батарею из этих элементов, которая впоследствии была названа «вольтовым столбом». Это изобретение впоследствии использовали другие ученые в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Даниельусовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниеля».
В 1859 году французский физик Гастон Плантэ изобрел свинцово-кислотный аккумулятор, поместив скрученную в рулон тонкую свинцовую пластину в серную кислоту. Этот тип элемента и по сей день используется в автомобильных аккумуляторах.
В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещен агломерат из оксида марганца(IV) MnO2с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.
В 1890 году в Нью-Йорке Конрад Губерт, иммигрант из России, создает первый карманный электрический фонарик. А уже в 1896 году компания National Carbonприступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
Самый долгоживущий гальванический элемент — серебрянно-цинковая батарея, изготовленная в Лондоне в 1840 году. Подключенный к двум таким последовательно соединенным батареям звонок работает и по сей день в Кларендонской лаборатории Оксфорда.
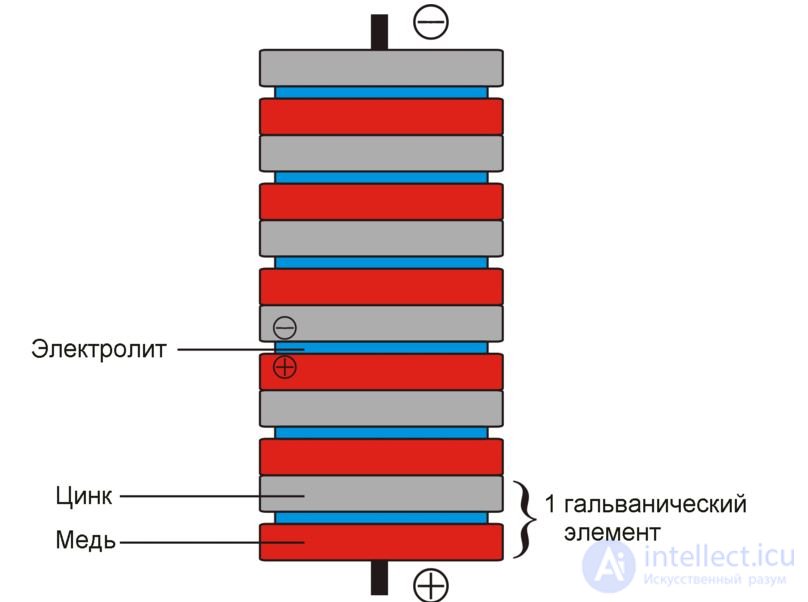
Основу химических источников тока составляют два электрода (отрицательно заряженный анод, содержащий восстановитель, и положительно заряженный катод, содержащий окислитель), контактирующие с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделенных процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода (отрицательного полюса химического источника тока) к положительному. Об этом говорит сайт https://intellect.icu . Это соответствует протеканию электрического тока в направлении от положительного полюса к отрицательному, так как направление тока совпадает с направлением движения положительных зарядов в проводнике.
В современных химических источниках тока используются:
По возможности или невозможности повторного использования химические источники тока делятся на:
Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка.
По типу используемого электролита химические источники тока делятся на кислотные (например свинцово-кислотный аккумулятор, свинцово-плавиковый элемент),щелочные (например ртутно-цинковый элемент, ртутно-кадмиевый элемент, никель-цинковый аккумулятор, никель-кадмиевый аккумулятор) и солевые (например,марганцево-магниевый элемент, цинк-хлорный аккумулятор).
Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока.
Смотрите также Категория: Гальванические элементы.
| Тип | Катод | Электролит | Анод | Напряжение, В |
|---|---|---|---|---|
| Марганцево-цинковый элемент | MnO2 | KOH | Zn | 1.56 |
| Марганцево-оловянный элемент | MnO2 | KOH | Sn | 1.65 |
| Марганцево-магниевый элемент | MnO2 | MgBr2 | Mg | 2.00 |
| Свинцово-цинковый элемент | PbO2 | H2SO4 | Zn | 2.55 |
| Свинцово-кадмиевый элемент | PbO2 | H2SO4 | Cd | 2.42 |
| Свинцово-хлорный элемент | PbO2 | HClO4 | Pb | 1.92 |
| Ртутно-цинковый элемент | HgO | KOH | Zn | 1.36 |
| Ртутно-кадмиевый элемент | HgO2 | KOH | Cd | 1.92 |
| Окисно-ртутно-оловянный элемент | HgO2 | KOH | Sn | 1.30 |
| Хром-цинковый элемент | K2Cr2O7 | H2SO4 | Zn | 1.8—1.9 |
Другие типы:
Электрический аккумулятор — химический источник тока многоразового действия (то есть в отличие от гальванического элемента химические реакции, непосредственно превращаемые в электрическую энергию, многократно обратимы). Электрические аккумуляторы используются для накопления энергии и автономного питания различных устройств.
Смотри также Категория: Аккумуляторы.
Топливный элемент — электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне — в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе.
Смотри также Категория: Топливные элементы.
Аккумулятор (автомобильный обычный) — устройство способное как поглощать (заряд) так и отдавать (разряд) электрическую энергию в результате обратимой химической реакции происходящей внутри устройства. Аккумулятор автомобильный обычный является не источником тока, а источником электрической энергии, а более точно, источником напряжения. Поскольку только источник напряжения способен поддерживать заданную величину разности потенциалов при изменении сопротивления нагрузки.
К сожалению, в одной статье не просто дать все знания про химический источник тока. Но я - старался. Если ты проявишь интерес к раскрытию подробностей,я обязательно напишу продолжение! Надеюсь, что теперь ты понял что такое химический источник тока и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Источники питания радиоэлектронной аппаратуры
Из статьи мы узнали кратко, но содержательно про химический источник тока
Комментарии
Оставить комментарий
Источники питания радиоэлектронной аппаратуры
Термины: Источники питания радиоэлектронной аппаратуры