Лекция
Это окончание невероятной информации про .
...
style="text-align:justify">откуда получаем
|
|
|
(7) |
Используя (7) при
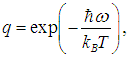
получаем из (6) выражение для искомого среднего
|
|
|
(8) |
Теперь легко получить среднюю энергию осциллятора
|
|
|
(9) |
где функция cth — гиперболический котангенс определена соотношением
|
|
|
(10) |
На рис. 3.10 сплошной линией изображена средняя энергия квантового осциллятора, измеренная в единицах ħω,
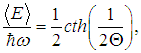
в зависимости от «безразмерной температуры»
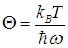
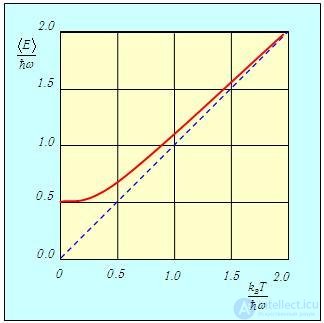
Рис. 3.10. Средняя энергия квантового осциллятора в зависимости от температуры
Пунктирная линия
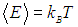
соответствует результату классической физики. Действительно, энергия
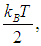
приходящаяся на одну степень свободы, является средним значением как кинетической, так и потенциальной энергий классического осциллятора, так что среднее значение полной энергии как раз равно
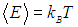
Видно, что квантовые поправки важны при низких температурах: при q < 0,3 средняя энергия осциллятора близка к энергии основного состояния ħω/2. В таком случае говорят, что колебательные степени свободы «заморожены», то есть тепловой энергии недостаточно для возбуждения колебаний. Но уже при q = 2 обе энергии практически совпадают, то есть квантовые поправки малы. Значение q = 1 можно принять за условную границу между квантовой и классическими областями. Ее смысл прозрачен: при
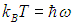
тепловая энергия равна минимальной энергии возбуждения осциллятора, то есть разности между энергией
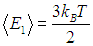
первого возбужденного состояния и энергией
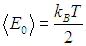
основного состояния осциллятора.
Какие же температуры можно считать низкими для осциллятора, моделирующего реальную систему, например молекулу водорода Н2? Характерные частоты молекулярных колебаний располагаются обычно в инфракрасной области и имеют порядок n = 1014 Гц. Этому соответствуют энергия
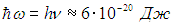
и температура
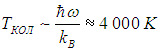
Средняя энергия квантового ротатора. Таким образом, привычные для нас комнатные температуры оказываются достаточно низкими с точки зрения возбуждения колебаний молекул. Посмотрим, что происходит с молекулами при температурах Т < ТК0Л. Так как колебания отсутствуют, двухатомную молекулу можно представить в виде «гантели» — двух атомов, жестко соединенных между собой. Такая система называется ротатором и, как мы видели ранее, имеет пять степеней свободы - три поступательных (движение центра масс) и две вращательных. Энергия вращательного движения классического ротатора имеет вид (3.61). Учитывая связь
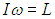
между угловой частотой вращения ω, моментом инерции I и моментом импульса L, записываем классическую энергию вращения молекулы как
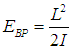
В квантовой механике квадрат момента импульса квантуется,
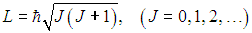
Здесь J — ротационное квантовое число, поэтому квантуется и энергия вращательного движения молекулы
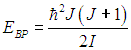
Используя это соотношение и распределение Максвелла — Больцмана, можно получить выражение для средней энергии квантового ротатора. Однако в этом случае формулы достаточно сложны, и мы ограничимся качественными результатами. При высоких температурах средняя энергия стремится к классическому значению kBТ, соответствующему двум степеням свободы (вращение вокруг двух ортогональных осей). При низких температурах ротатор будет находиться в основном состоянии, соответствующем значению J = 0 (отсутствие вращения). «Переход» между двумя этими предельными случаями осуществляется, очевидно, при такой температуре ТВР когда тепловое движение способно возбудить вращательные степени свободы. Минимальная (отличная от нуля) энергия вращения равна
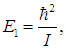
как это следует из формулы для ЕВР при J = 1. Поэтому
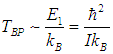
Для момента инерции молекулы можно принять оценку
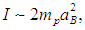
где mр = 1,67·10–27 кг (масса протона), а аВ = 5·10–11 м — радиус Бора. Получаем тогда
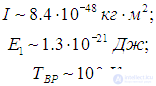
Полученные оценки подтверждаются измерениями молярной теплоемкости при постоянном объеме сnV, которые мы уже обсуждали в предыдущей главе. При температурах ниже 100 К в тепловом движении участвуют только поступательные степени свободы молекулы. Средняя энергия молекулы равна 3kBТ/2, а энергия одного моля — 3NAkBT/2=3RT/2, откуда следует выражение для теплоемкости сnV = 3R/2. В диапазоне температур от 100 К до 200 К молярная теплоемкость увеличивается до значения сnV = 5R/2, что свидетельствует о «размораживании» двух дополнительных (вращательных) степеней свободы (то есть о добавлении kBT энергии на молекулу). В районе температур от 4 000 К до 5 000 К молярная теплоемкость снова увеличивается, на этот раз до значения сnV = 7R/2. Это «разморозилась» колебательная степень свободы, что принесло дополнительную энергию kBT на молекулу.
Скорость химических реакций. У химиков есть эмпирическое правило, что при повышении температуры на 10 °С скорость реакции удваивается. Это — всего лишь грубое обобщение, из него есть множество исключений, но все же в целом оно более или менее верно. Объяснение можно и здесь дать на основе распределения Максвелла — Больцмана.
Для протекания многих химических реакций необходимо, чтобы энергия участвующих в них частиц превышала некое пороговое значение, которое мы обозначим Е0. Чем больше таких частиц, тем выше скорость реакции. Из формул (3.28), (3.29) следует распределение частиц по энергиям. В них надо лишь выразить скорость частицы v через ее кинетическую энергию Е
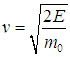
и учесть, что
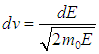
В результате получаем распределение частиц по энергиям
|
|
|
(11) |
Отсюда находим число частиц с энергией Е > Е0:
|
|
|
(12) |
где мы сделали замену переменных интегрирования
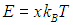
Для численных оценок мы примем пороговую энергию равной энергии возбуждения колебаний молекулы: Е0 = 6·10–20 Дж. Тогда для комнатной температуры Т1 = 300 К получаем величину E0/kBT1 = 14,5, а для температуры Т2 = 310 К это отношение равно Е0/kBТ2 = 14,0. Числа частиц, участвующих в реакции, определяются соотношениями
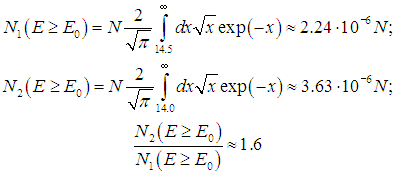
Действительно, повышение температуры всего на 10 градусов привело к увеличению на 60 % числа частиц, энергия которых превышает пороговое значение.
Исследование, описанное в статье про 3. Распределение молекул по скоростям и координатам, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое 3. Распределение молекул по скоростям и координатам и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Молекулярная физика и термодинамика
Часть 1 3. Распределение молекул по скоростям и координатам
Часть 2 3.3. Характерные скорости молекул - 3. Распределение молекул по скоростям
Часть 3 3.4. Распределение молекул по координатам - 3. Распределение молекул по
Часть 4 - 3. Распределение молекул по скоростям и координатам
Комментарии
Оставить комментарий
Молекулярная физика и термодинамика
Термины: Молекулярная физика и термодинамика