Лекция
Привет, Вы узнаете о том , что такое 5. Растворы электролитов. Окислительно-восстановительные процессы, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое 5. Растворы электролитов. Окислительно-восстановительные процессы , настоятельно рекомендую прочитать все из категории Химия углубленный курс.
История создания теории электролитической диссоциации является характерным
примером построения научного знания – от экспериментальных данных (эмпирического
материала) к идеализированным образам (физической модели) и математическому
описанию.
Экспериментальные данные:
При измерении рассмотренных ранее параметров растворов – понижения
температуры замерзания ΔTз раствора по сравнению с чистым растворителем, повышения
температуры кипения ΔTк , осмотического давления π – обнаружено, что вещества,
растворы которых проводят электрический ток, дают завышенные значения, причем
коэффициент превышения экспериментальной величины по сравнению с вычисленной по
молекулярной массе один и тот же:
i = ΔTз(эксп)/ΔTз(теор) = ΔTк(эксп)/ΔTк(теор) = π(эксп)/π(теор)
Вант-Гофф назвал поправочный коэффициент i изотоническим.
Объяснение – диссоциация растворенных частиц.
Демонстрации:
а) электропроводность раствора уксусной кислоты по мере разбавления;
б) электропроводность спиртового и водного растворов хлорида кобальта.
Вещества, которые в растворе или в расплаве частично или полностью распадаются
на ионы и проводят электрический ток за счет движения ионов, называются
электролитами.
Степень диссоциации:
α = (число диссоц. молекул)/(общее число молекул раств. в-ва)
α = (i - 1)/(n - 1)
n – число ионов при диссоциации одной формульной единицы.
Объяснение эффектов наличием ионов соответствует построению физической модели
явления.
Сам факт диссоциации был известен раньше – еще в 1834 г. М.Фарадей (1791-1867)
сформулировал законы электролиза и тогда же предложил термины “ион”, “катион”,
“анион”. Однако до работ Аррениуса (1887) считалось, что диссоциация электролитов
возможна только под действием электрического поля. Против теории Аррениуса возражал
Д.И.Менделеев в 1889 г.
Для таких возражений имелись вполне серьезные аргументы. Вот некоторые из
них. Предположим, что 1 моль поваренной соли (примерно 58,5 г или столовая ложка
хлорида натрия), нужно разделить на положительные и отрицательные ионы со средним
расстоянием между ними 1 см. По закону Кулона:
F = 9,2*108 кг*м2*Кл-2*(q1*q2)/ r2
при q1 = q2 = 1,6*10–19 Кл получим F = 9,2*108 (1,6*10–19)2 /10–4 кг
Но это расчет для двух ионов, а для моля в числителе появляется (6*1023)2 и тогда
итоговое значение силы притяжения 8,5*1022 кг(!). При уменьшении среднего расстояния
между ионами сила эта возрастает. Следовательно, “разорвать” моль поваренной соли на
ионы практически невозможно. Понятие о взаимодействии ионов с диполями воды,
благодаря которому происходит диссоциация, возникло далеко не сразу.
Классификация электролитов по силе субъективна
Сильные α > 0,7; средней силы 0,7 > α > 0,3; слабые α < 0,3
(по учебнику МГУ под ред. Е.М.Соколовской и Л.С Гузея).
Альтернатива:
для 0,1 М раствора сильные α > 0,3; средней силы 0,3 > α > 0,03; слабые α < 0,03
(по учебнику 1 Мед. Ю.А.Ершов, В.А.Попков ...)
Для слабых электролитов в справочных таблицах обычно приводят
константы диссоциации или их отрицательные десятичные логарифмы.
HA ↔ H+ + A– Ка = Ккисл = [H+][ A–]/[HA]
pКкисл = -lg (Ккисл)
Для уксусной кислоты Ккисл = 1,8*10-5; рКкисл = 4,8
Закон разбавления (Оствальда)
Для равновесия AK ↔ A– + K+
концентрация ионов Сион = С0α;
константа диссоциации Кд = С0
2α2/(1 - α)С0 = α2С0/(1 - α)
Для слабого электролита, когда α << 1
Кд = α2С0 α ≅ (Кд/С0)1/2
Равновесия в растворах
Для описания кислотно-основных равновесий в водных растворах вполне
пригодна классическая теория Аррениуса:
Кислотой называют электролит, диссоциирующий в растворах с образованием
ионов Н+ ; основанием называют электролит, диссоциирующий в воде с образованием
гидроксид-ионов ОН– . Амфолитом (амфотерным гидроксидом) называют электролит,
диссоциирующий в воде с образованием как ионов Н+, так и ионов ОН– .
Протонная теория кислот и оснований (И.Бренстед, Т.Лоури, 1923 )
Кислотой называют вещество, молекулярные частицы которого (в т.ч. ионы)
способны отдавать протон (доноры протонов); молекулярные частицы основания
способны присоединять протоны (акцепторы протонов).
NH4
+ ↔ NH3 + H+
кислота основание
Протолитическое равновесие в воде:
H2O ↔ H+ + OH–
Кр = [H+][OH–]
[H2O]
При постоянной температуре в разбавленных растворах концентрация воды в воде [H2O]
постоянная и равна 55,5 моль/л (1000 г/18г*моль).
Кр[H2O] = Kw = [H+][OH–] = 10-14
При строгом термодинамическом рассмотрении (концентрации заменены активностями)
принимаем активность растворителя (воды) равной 1 (см. лекция 3, таблица 1) и получаем
то же выражение Kw = [H+][OH–] = 10-14 .
Тогда [H+] = 10-7. На практике из-за удобства измерения (см. ниже) и записи используют
величину рН = -lg [H+]
Для чистой воды при стандартных условиях рН = 7
При рН > 7 раствор щелочной;
при рН < 7 раствор кислый
При нормальных условиях (00 С):
Kw = 1,14*10-15 , тогда [H+] = 3,37*10-7 и рН = -0,53 + 7 = 6,47
Буферные растворы
рН буферных растворов сохраняется практически постоянным при разбавлении
или при добавлении небольших количеств сильной кислоты или сильного основания.
Буферным действием обладают:
1. Система слабая кислота – ее соль с сильным основанием, а также сочетание кислой и
средней солей слабых кислот или двух кислых солей. Примеры:
Система Область буферного действия
CH3COOH/CH3COONa pH: 3,8 ÷ 5,8
H2CO3/NaHCO3 pH: 5,4 ÷ 7,4
NaHCO3/Na2CO3 pH: 9,3 ÷ 11,3
NaH2PO4/Na2HPO4 pH: 6,2 ÷ 8,2
2. Система слабое основание – его соль с сильной кислотой:
NH3*H2O/NH4Cl pH: 8,2 ÷ 10,2
3. Ионы и молекулы амфолитов – аминокислотные и белковые системы.
Значение рН, при котором аминокислота существует только в виде внутренней
соли I , называется изоэлектрической точкой. При электролизе такого раствора
аминокислоты она не перемещается ни к катоду, ни к аноду. В более кислых средах
аминокислоты перемещаются в виде катиона II в сторону катода, в менее кислых – в виде
аниона III в сторону анода.
II H+ I OH- III
H3N+-CHR-COOH ← H3N+-CHR-COO- → H2N-CHR-COO-
Понятие изоэлектрической точки применимо и к продуктам поликонденсации
аминокислот – белкам. Об этом говорит сайт https://intellect.icu . В изоэлектрическом состоянии аминокислоты и белки не
проявляют буферных свойств. Буферное действие возникает при добавлении к ним
небольшого количества сильной кислоты или щелочи.
Буферная емкость измеряется количеством кислоты или щелочи (моль или ммоль
эквивалентов), добавление которого к 1 л буферного раствора изменяет рН на единицу.
Механизм буферного действия хорошо описан в рекомендованной литературе ,
поэтому приведем только готовые формулы для расчета рН:
Для кислотного буфера pH = pKкисл + lg[соль]/[кислота];
Для осно’вного буфера pH = 14 - pKосн - lg [соль]/[основание]
pKкисл и pKосн – соответственно отрицательные десятичные логарифмы констант
диссоциации слабой кислоты и слабого основания.
Для слабо растворимых или “нерастворимых” веществ в справочных таблицах
приводят величины ПР. Считается, что малорастворимые соли могут переходить в раствор
только в виде ионов:
AKтв ↔ A– + K+
Тогда Кр = [A–][ K+]/[AKтв]; при постоянной температуре [AKтв] постоянна,
тогда Kр[AKтв] = ПР = [A–][ K+]
При строгом термодинамическом рассмотрении (концентрации заменены активностями)
принимаем активность чистого твердого вещества равной 1 (см. лекция 3, таблица 1) и
получаем то же выражение ПР = [A–][ K+].
Для соли Ca3(PO4)2 :
Ca3(PO4)2 ↔ 3 Ca2+ + 2 PO4
3-
ПР = [Ca2+]3[PO4
3-]2
Поскольку постоянная при tпост величина ПР выражает равновесие, при добавлении
избытка одного из ионов, входящих в формулу, концентрация второго иона должна
понизиться.
Измеримые свойства растворов сильных электролитов указывают на формально
неполную диссоциацию последних. Это связано с электростатическим (кулоновским)
взаимодействием между окруженными сольватными оболочками ионами. Поэтому при
строгой записи всех приведенных выше формул надо пользоваться не концентрациями, а
активностями электролитов a: a = fC f – коэффициент активности.
Для определения f нужно вычислить ионную силу раствора I = 0,5ΣCмn2 ,
где Cм – моляльная концентрация иона, а n – его заряд.
-lgf = 0,502 n2(I)1/2 (уравнение Дебая-Гюккеля)
Окислительно-восстановительные процессы
Стандартная процедура: «уравнивание» окислительно-восстановительных реакций
(обычно используется метод электронного или электронно-ионного баланса).
Демонстрации:
а) перманганат калия в нейтральной, кислой и щелочной среде
нейтральная среда (Mn+7 → Mn+4 )
2 KMnO4 + H2O + 3 Na2SO3 = 2 MnO2 + 2 KOH + 3 Na2SO4
кислая среда (Mn+7 → Mn+2 )
2 KMnO4 + 3 H2SO4 + 5 K2SO3 = 2 MnSO4 + 3 H2O + 6 K2SO4
2 KMnO4 + 5 SO2 + 2 H2O = 2 MnSO4 + K2SO4 + 2 H2SO4
щелочная среда (Mn+7 → Mn+6 )
2 KMnO4 + 2 KOH + Na2SO3 = 2 K2MnO4 + H2O + K2SO4
Перенос электронов в ОВР реален и используется для практических целей.
Демонстрации:
а) энергия обменной реакции (порошок магния и хлорной меди в присутствии воды).
б) элемент Даниэля (Zn + CuSO4 = ZnSO4 + Cu)
При проведении на раздельных электродах реакции вытеснения цинком меди из
раствора:
Zn + CuSO4 = ZnSO4 + Cu или Zn + Cu2+ = Zn2+ + Cu
можно использовать электрический ток, возникающий между электродами, для
выполнения работы.
В справочных таблицах приводят стандартные электродные потенциалы ряда
металлов, показывающие возможность переноса электронов между ними. Эти данные
получены для систем, содержащих водный раствор ионов металла с концентрацией
(активностью) 1 М и электрод из этого металла; электрический потенциал Е определяется
относительно стандарта – водородного электрода. Значения стандартных потенциалов
даются для процесса восстановления (принятия электронов) в расчете на один
перенесенный электрон.
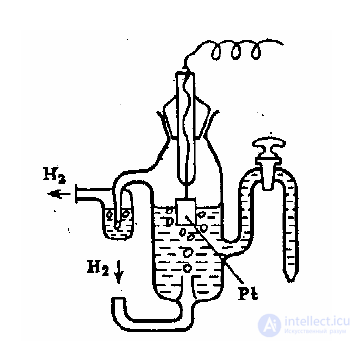
Рис. 1 Водородный электрод. Концентрация Н+ в растворе 1 М, давление Н2 – 1 атм.
Потенциал системы из двух металлов вычисляется по таблицам.
Для системы Zn + Cu2+ = Zn2+ + Cu
Е0 = Е0(ок-ль) - Е0(восст-ль) = +0,34 - (-0,76) = 1,1 В
Для определения направления окислительно-восстановительной реакции
пользуются расширенными таблицами стандартных электродных потенциалов.
Полуреакция (восстановление окисленной формы) E0 , В


Пример 1:
Какая реакция пойдет в кислой среде при концентрациях 1 моль/л: окисление Cl– до Cl2
азотной кислотой, которая восстановится до NO , или окисление NO2 до азотной кислоты
хлором?
Решение: В ряду потенциалов: Cl2 + 2 e– = 2 Cl– E0 = +1,36 В
NO3
– + 4 H+ + 3 e– = NO + 2 H2O E0 = +0,96 В
NO3
– + 2 H+ + e– = NO2 + 2 H2O E0 = +0,78 В
Чем выше потенциал присоединения электрона (больше +), тем сильнее окислитель (в
уравнении слева). Значит, хлор будет окислять NO2 :
Cl2 + 2 NO2 + 2 H2O = 2 HNO3 + 2 HCl
Пример 2:
Пользуясь таблицей стандартных электродных потенциалов, обсудите возможность
взаимодействия между серной кислотой и бромидом калия.
Решение: Стандартные потенциалы 1 М серной кислоты как окислителя (+0,20 В и
+ 0,15 В) ниже, чем потенциал брома, как окислителя (+1,07 В). Следовательно, в 1 М
растворе бром может окислить сульфиты и сульфиды до сульфатов, но серная кислота не
будет окислять бромид. Если же сухой бромид калия поместить в концентрированную
серную кислоту, будет выделяться бром:
3 H2SO4 + 2 KBr = 2 KHSO4 + SO2 + Br2 + 2 H2O
Следовательно, концентрированная серная кислота – более сильный окислитель, чем
бром, ее фактический потенциал выше 1,07 В. Предсказания на основе стандартных
потенциалов действительны только для водных 1 М растворов.
Элемент Лекланше (Ж.Лекланше, 1865 г.) :
Электролит – крахмальная паста с NH4Cl
(-)Zn| NH4Cl, ZnCl2 |MnO2 (+)
2 MnO2 + 2 NH4Cl + Zn = 2 MnOOH + Zn(NH3)2Cl2 + H2O
Свежий от 1,55 до 1,85 В; емкость 30-50 Вт*ч/кг
“Щелочные” (Alkaline) Мировое производство 7-9 млрд штук в год
Электролит – KOH, ингибиторы
(-)Zn| KOH |MnO2 (+)
2 MnO2 + Zn + H2O = 2 MnOOH + ZnO
емкость 60-90 Вт*ч/кг
“Литиевые”
(-) Li | LiClO4 в пропиленкарбонате | MnO2 (+)
Li + MnO2 = LiMnO2
(-) Li | LiBF4 в гамма-бутиролактоне | (CFx)n (+)
xn Li + (CFx)n = xn LiF + n C
емкость 600-1200 Вт*ч/кг
Аккумуляторы [10]
Свинцовые [11]: ЭДС мин. 2,1 В; зарядный ток = 1/10 емкости;
емкость 3-4 А*ч/кг
PbO2 + 2 H2SO4 + Pb ↔ PbSO4 + 2 H2O + PbSO4 → разряд
(+) (-)
100 млн. автомобильных аккумуляторов в год – 2 млн. т. свинца (50% производства Pb)
Серебряно-цинковые: ЭДС мин. 1,5 В; зарядный ток = 1/10 емкости;
емкость 50-70 А*ч/кг
Ag2O + KOH + Zn ↔ 2 Ag + KOH + ZnO → разряд
(+) (-)
Щелочные (кадмиево-никелевые): ЭДС мин. 1,1 В; зарядный ток = 1/4 емкости;
емкость 3,5-8 А*ч/кг
2 Ni(OH)3 + KOH + Cd (Fe) ↔ 2 Ni(OH)2 + KOH + Cd(OH)2 → разряд
(+) (-)
Никель-гидридные [12]: ЭДС мин. 1,2 В; зарядный ток = 1/10 емкости;
емкость 5-12 А*ч/кг
NiOOH + MHab ↔ Ni(OH)2 + M → разряд
(+) (-)
M: TiFe; ZnMn2 ; Mg2Ni; LaNi5
Литий-ионные [13] : ЭДС мин. 3,6 В; зарядный ток = 1/2-1/4 емкости
емкость 7-20 А*ч/кг
Li1-x CoO2 + CLix ↔ LiCoO2 + C → разряд
(+) (-)
Критерий возможности самопроизвольного протекания электрохимической
(окислительно-восстановительной) реакции тот же – отрицательная ΔG реакции.
Представляется интересным связать термодинамический критерий с измеряемыми
электрическими величинами. 1 джоуль соответствует энергии заряда в 1 кулон,
прошедшего разность потенциалов 1 вольт:
1 Дж = 1 В А с = В Кл
1 моль зарядов – число Фарадея F, равное 96487 Кл или примерно 96500 Кл. Тогда
получим соотношение для n-зарядных ионов:
ΔG = - nFE
E – электродвижущая сила (ЭДС) – напряжение источника тока в отсутствие
внешней нагрузки (измеряется приборами с большим внутренним сопротивлением).
В общем случае для реакции: aA + bB → xX + yY

В положении равновесия ΔG = 0 и ΔG0 = -RTlnKр, где
 константа равновесия
константа равновесия
Тогда:
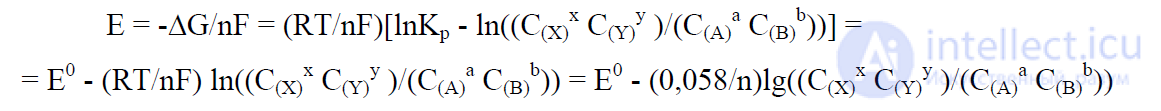
Здесь n – число электронов, переходящих в процессе aA + bB → xX + yY, допустим, для
реакции Cl2 + 2 NO2 + 2 H2O = 2 HNO3 + 2 HCl (пример 1, см. выше) переходит при
данной записи 2 электрона, уравнение будет выглядеть (в разбавленном растворе
активность H2O равна 1):
E = 1,36 - 0,78 - (0,058/2)lg ([HNO3]2[HCl]2)/[Cl2][NO2]2)
Это и есть уравнение Нернста [14].
Строго говоря, нужно вместо концентраций пользоваться активностями ионов.
Для процесса Zn + Cu2+ = Zn2+ + Cu
E = E0 - (0,058/n)lg([Zn2+]/[Cu2+]) =
= E0 - (0,058/n)lg([отдавший электроны восстановитель]/[берущий электроны
окислитель])
При стандартных концентрациях 1 М получим:
E = E0
окисл - E0
восст = +0,34 – (-0,76) = 1,1 В
Критерием самопроизвольного электрохимического процесса может служить при такой
форме записи положительная величина потенциала Е.
Из уравнения Нернста следует, что разность потенциалов возможна для одного и
того же иона (E0
1 равно E0
2) за счет разных концентраций. Например, для двух
водородных электродов:
E = E2 - E1 = (0,058/n)lg([H+]2/[H+]1) = 0,058 lg([H+]2/[H+]1)
Если для одного из электродов [H+]1 = 1 М (стандартный раствор), получим:
E = 0,058 lg[H+]2 или E = - 0,058 рН
Получается, что рН раствора можно определить, измеряя ЭДС электрода.
На практике используют электрод из тонкого стекла с повышенным содержанием
ионов щелочных металлов. Внутри электрода содержится стандартный раствор с [H+]1 ;
тогда его потенциал относительно второго электрода сравнения:
E = E0
c + 0,058 lg([H+]2/[H+]1)
E0
c – индивидуальная характеристика электрода (приравнивается “0” при
настройке).
Стеклянный электрод для измерения рН изобрел в 1909 г. Фриц Габер [15].
В настоящее время используют ионоселективные электроды со стеклянными,
полимерными, поликристаллическими и жидкими (пластифицированными) мембранами.
Их активные компоненты – ионообменные полимеры, хелаты, краун-эфиры и
циклические природные антибиотики. Например, антибиотик валиномицин селективно
связывает катионы калия.
Коэффициент селективности ионоселективных электродов достигает 10-3 ÷ 10-5 –
это означает, что более чем тысячекратный избыток посторонних ионов не мешает
анализу [16].
Дополнение 1 к лекции 5
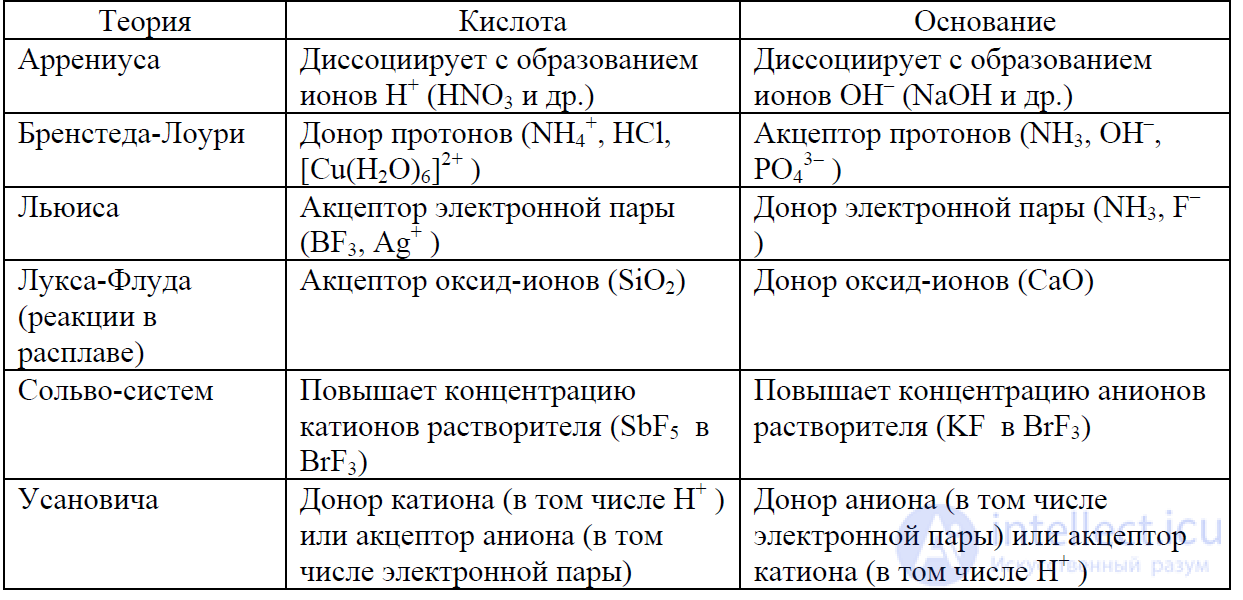
Основные определения кислот и оснований [17]
Дополнение 2 к лекции 5
Расчет рН в растворах сильных кислот и оснований
Диссоциация сильной кислоты: HCl → H+ + Cl-
Считаем диссоциацию полной (α = 100%): [H+] = [HCl]
pH = - lg [HCl]
Диссоциация сильного основания: NaOH → Na+ + OH-
Считаем диссоциацию полной (α = 100%): [OH-] = [NaOH]
pOH = - lg [NaOH] ;
при 250С [H+][OH-] = 10-14 pH + pOH = 14
pH = 14 - pOH
Расчет рН слабой кислоты и кислотного буфера
Диссоциация слабой кислоты: CH3COOH ↔ CH3COO- + H+
(α << 100%)
В общем виде: HA ↔ H+ + A– Ка = Ккисл = [H+][ A–]/[HA]
pКкисл = -lg (Ккисл)
Считая слабую кислоту единственным источником протонов (допущение 1)
и приравнивая равновесную концентрацию [HA] к исходной [HA]0 (допущение 2):
Ккисл = [H+]2/[HA]0 [H+] = (Ккисл [HA]0 )1/2
В кислотном буферном растворе присутствует соль слабой кислоты,
диссоциацию соли при расчетах считают полной (α = 100%):
CH3COONa → CH3COO- + Na+
Чтобы вычислить [H+] и рН,
считают слабую кислоту единственным источником протонов (допущение 1),
равновесную концентрацию анионов [ A–] считают равной исходной концентрации соли
[ANa]0 (допущение 2),
равновесную концентрацию [HA] считают равной исходной концентрации кислоты [HA]0
(допущение 3)
Тогда Ккисл = [H+] [ANa]0/[HA]0 [H+] = Ккисл [HA]0/[ANa]0
pH = pKкисл – lg [HA]0/[ANa]0 = pKкисл + lg [ANa]0/[HA]0
pH = pKкисл + lg [соль]0/[кислота]0
Для осно’вного буфера pH = 14 - pKосн - lg [соль]0/[основание]0
Дополнение 3 к лекции 5
Значения рН различных биожидкостей и тканей организма человека [18]

Дополнение 4 к лекции 5
Буферная емкость почв [19]
В почвах катионы водорода, приносимые дождевой водой или образующиеся в
результате жизнедеятельности, вытесняют из твердой фазы ионы Ca2+. В результате почва
приобретает определенную буферную емкость – при добавлении щелочных веществ
ионы H+, связанные с твердой фазой почвы, переходят в почвенный раствор, компенсируя
потери этим раствором ионов H+ при нейтрализации щелочами. Из кислых глинистых
минералов наибольшей буферной емкостью обладают минералы ленточного строения –
вермикулит (Mg, Ca)0,7 (Mg, Fe3+, Al)6 (Al, Si)8O20
.8H2O и монтмориллонит
Na0,7(Al3,3Mg0,7)(Si8O20).nH2O.
Буферная емкость океана [20]
Мировой океан обладает огромной буферной емкостью, потому что он является
открытой системой. Основная буферная реакция – равновесие при диссоциации угольной
кислоты:
H2CO3 ⇔ H+ + HCO3
-
При понижении кислотности происходит дополнительное поглощение углекислого газа из
атмосферы с образованием кислоты:
CO2 + H2O ⇔ H2CO3
При повышении кислотности происходит растворение карбонатных пород (раковины,
меловые и известняковые отложения в океане); этим компенсируется убыль
гидрокарбонатных ионов:
H+ + CO3
2- ⇔ HCO3
-
CaCO3(тв.) + CO2 + H2O ↔ Ca2+ + 2 HCO3
-
Твердые карбонаты переходят в растворимые гидрокарбонаты. Именно этот процесс
химического растворения избыточного углекислого газа противодействует “парниковому эффекту” – глобальному потеплению из-за поглощения углекислым газом теплового
излучения Земли.
Исследование, описанное в статье про 5. Растворы электролитов. Окислительно-восстановительные процессы, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое 5. Растворы электролитов. Окислительно-восстановительные процессы и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Химия углубленный курс
Комментарии
Оставить комментарий
Химия углубленный курс
Термины: Химия углубленный курс