Лекция
Привет, Вы узнаете о том , что такое люминофор, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое люминофор, люминесценция, фосфоресценция , настоятельно рекомендую прочитать все из категории Прикладная физика.
Химический источник света, хемилюминесцентные источники света (ХИС) — устройства, генерирующие свет при протекании химической реакции: например, каталитической реакции некоторых сложных эфиров щавелевой кислоты с пероксидом водорода в присутствии люминофор а. Наружная трубка содержит часть химической смеси. Внутренняя трубка, содержащая остальную смесь, сделана из стекла или другого хрупкого материала. Если светильник сложить, внутренняя трубка сломается, и химикаты смешаются. Это приводит к реакции, которая дает свет, но не обязательно тепло. Это явление называется хемилюминесценцией.
Широко применяются в качестве автономных (до 12 часов свечения ) источников света при различных аварийно-спасательных, дорожных, уличных работах, в чрезвычайных ситуациях, в туризме и спелеологии, подводном плавании, для подачи сигналов, вообще в качестве различного рода резервных осветителей, в декоративном освещении, для развлечений. Будучи полностью автономными, прочными, пожаробезопасными и водонепроницаемыми, пригодными для долгого хранения, источники могут использоваться в широком диапазоне применений. Выпускаются, как правило, в виде пластиковых палочек или браслетов, которые при надламывании начинают светиться бледным светом.
Цвет источников может иметь флуоресцентные оттенки различных цветов, как правило зеленого, голубого, или оранжевого .
Обычно бытовые ХИС обеспечивают освещенность около 100 люкс сразу после активирования, снижая мощность до 20−40 люкс через 10−15 минут .
Светящиеся палочки водонепроницаемы, не используют батарейки, выделяют незначительное тепло, недороги и достаточно одноразовые. Они могут выдерживать высокое давление, например, под водой. Они используются в качестве источников света и световых маркеров военными, туристами и дайверами . [12]
Glowsticking - это использование светящихся палочек в танце. [13] Они часто используются для развлечения на вечеринках (в частности, рейвах ), концертах и танцевальных клубах . Они используются оркестр проводников для вечерних представлений; Светящиеся палочки также используются на фестивалях и праздниках по всему миру. Светящиеся палочки также выполняют несколько функций в качестве игрушек, хорошо заметных ночных предупреждений для автомобилистов и световых меток, которые позволяют родителям следить за своими детьми. Другое использование - для световых эффектов, переносимых воздушными шарами . Светящиеся палочки также используются для создания специальных эффектов в фотографии и на пленке при слабом освещении. [14]
Книга рекордов Гиннеса зафиксировала, что самая большая в мире светящаяся палочка треснула на высоте 150 метров (492 фута 2 дюйма). Он был создан факультетом химии Университета Висконсина-Уайтуотера в ознаменование полутора столетия или 150-летия школы в Уайтуотере, штат Висконсин, и дал трещину 9 сентября 2018 г. [15]
Светящиеся палочки используются для отдыха на природе, часто используются ночью для маркировки. Аквалангисты используют светящиеся палочки для дайвинга, чтобы пометить себя во время ночных погружений, а затем могут выключить яркий свет для дайвинга. Это сделано для обеспечения видимости биолюминесцентных морских организмов, которых нельзя увидеть, пока горит яркий свет для дайвинга. Точно так же светящиеся палочки используются на рюкзаках, вешалках для палаток и на куртках во время ночных походов. Часто светящиеся палочки рекомендуются в качестве дополнения к комплектам для выживания .
Существуют определенные промышленные применения светящихся палочек, которые часто используются в качестве источника света в условиях, когда электрическое освещение и светодиоды не подходят. Например, в горнодобывающей промышленности для аварийной эвакуации в случае утечки газа требуются светящиеся палочки. Использование электрического источника света в этом случае может вызвать непреднамеренный взрыв. Хеми люминесценция , тип света, используемый в светящихся палочках, представляет собой «холодный свет», не использует электричество и не вызывает воспламенения утечки газа.
Светящиеся палочки также используются во всем мире в морской промышленности, часто используются в качестве рыболовных приманок при ярусном, любительском и коммерческом рыболовстве, а также для обеспечения безопасности персонала.
Светящиеся палочки используются военными, а иногда и тактическими подразделениями полиции , чтобы отмечать очищенные комнаты или примечательные объекты во время зачистки зданий во время ближнего боя . Они также используются для идентификации дружественных солдат во время ночных операций. [16]
Свечи накаливания используются аварийными службами в качестве резервных источников света. Например, светящиеся палочки входят в комплект ООН для оказания чрезвычайной помощи людям, пострадавшим от стихийных бедствий и гуманитарных бедствий. Часто аварийно-спасательные бригады раздают светящиеся палочки, чтобы следить за людьми в ночное время, у которых может не быть доступа к собственному освещению. Светящиеся палочки иногда прикрепляют к спасательным жилетам и спасательным шлюпкам на пассажирских и коммерческих судах для обеспечения видимости в ночное время.
В общественном транспорте, например в метро, иногда доступны станции аварийного освещения с подсветкой для аварийного освещения, чтобы обеспечить безопасность пассажиров в случае возникновения чрезвычайной ситуации.
Регенерируемые «ХИС»
До конца 1990-х годов в массовой продаже встречались изделия, способные продолжить работу после полного затухания и окончания протекания химической реакции. После непродолжительного механического воздействия в течение 1−2 минут изделие испускало свет на протяжении 1−3 часов, в течение 4−5 циклов такой «перезарядки» постепенно интенсивность свечения снижалась, пока не сходила на нет. В 2000-х годах производство было остановлено из-за использования дорогостоящих материалов и их высокой токсичности.
Считается, что светящиеся палочки могут быть помещены в морозильник, чтобы замедлить химические реакции, что позволяет палочкам храниться в течение двух-трех ночей. Холод возбуждает переход смеси в твердое состояние и замедляет освобождение фотонов. Наоборот, под воздействием микроволнового излучения или горячей воды ускоряется освобождение фотонов и увеличивается яркость свечения, но уменьшается его продолжительность. Это, однако, как правило, зависит от конкретного состава химических веществ в конкретной светящейся палочке.
Жидкости, содержащиеся в некоторых ХИС (до десятков миллилитров), могут представлять опасность при нарушении целостности оболочки источника и попадании на кожу.
В светящихся палочках фенол образуется как побочный продукт. Желательно держать смесь подальше от кожи и предотвратить случайное проглатывание, если корпус светящейся палочки расколется или сломается. При попадании на кожу химические вещества могут вызвать легкое раздражение кожи, отек или, в крайних случаях, рвоту и тошноту. Некоторые из химических веществ, используемых в старых светящихся палочках, считались потенциальными канцерогенами . [24] В качестве сенсибилизаторов используются полиядерные ароматические углеводороды , класс соединений, известных своими канцерогенными свойствами.
Дибутилфталат, ингредиент, который иногда используют в светящихся палочках, вызывает некоторые проблемы со здоровьем. Он был внесен в список подозреваемых тератогенов в Калифорнии в 2006 году [25].
Светящиеся палочки содержат ингредиенты, которые действуют как пластификаторы. Это означает, что если светящаяся палочка попадет на пластик, он может стать жидким. [26]
Дифенилоксалат может вызывать ожоги глаз, раздражать кожу и вызывать ожоги во рту и горле при проглатывании.
Кроме того, использованные светящиеся палочки, которые остаются в окружающей среде, вызывают долговременное загрязнение. Об этом говорит сайт https://intellect.icu . В этом документе Nature Paper описываются многие вторичные реакции, которые продолжают реагировать в использованных светящихся палочках и химических лампах, используемых в морской промышленности (и аналогичны для всех типов светящихся стержней). [27] «Потеря жизнеспособности, изменения клеточного цикла и фрагментация ДНК наблюдались в клеточной линии HepG2 и фибробластах кожи. Нецитотоксическая концентрация LS (Light Stick) увеличивала возникновение мутагенного поражения 1, N6-εdAdo в ДНК HepG2 в 3 раза. Кроме того, инкубация использованного содержимого LS с ДНК in vitro приводила к образованию аддуктов dGuo-LS, выяснение структуры которых выявило присутствие реакционноспособного хлорированного продукта. В заключение было обнаружено, что содержимое LS является высоко цито- и генотоксичным. Наши данные указывают на острую необходимость в руководствах по обращению с отходами LS и в адекватной информации о токсических последствиях, которые могут возникнуть в результате воздействия на человека ».
Светящиеся палочки также вносят свой вклад в проблему пластиковых отходов , поскольку светящиеся палочки одноразовые и изготавливаются из пластика. Кроме того, поскольку внутренний флакон часто сделан из стекла, а химические вещества внутри опасны при неправильном обращении, пластик, используемый для светящихся палочек, не подлежит утилизации службами вторичной переработки, поэтому светящиеся палочки классифицируются как неперерабатываемые отходы.
По состоянию на 2021 год ведется работа по созданию более безопасных альтернативных светящихся палочек. Канадская компания Nyoka Design Labs [28] разрабатывает альтернативы светящимся стержням. Light Wand является биоразлагаемым и светится биолюминесценцией , а не хемилюминесценцией. LUMI - это нетоксичная альтернатива многоразового использования, которая светится фосфоресценцией и является химически и биологически инертной.
Люминофор (от лат. lumen — свет и др.-греч. φορός — несущий) — вещество, способное преобразовывать поглощаемую им энергию в световое излучение (люминесцировать).
Излучение света молекулами – люминесценция - может происходить при передаче энергии им в различных процессах: - воздействие потоком электронов (катодными лучами) – катодолюминесценция; - тепловой нагрев – термолюминесценция; - химические реакции – хемилюминесценция; - воздействие электрическим током – электролюминесценция; - ультразвуковое воздействие – сонолюминесценция; - воздействие механическим трением - триболюминесценция; - облучение ионизирующей радиацией – радиолюминесценция; - облучение ультрафиолетовым и видимым светом – фотолюминесценция или флуоресценция.


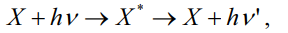
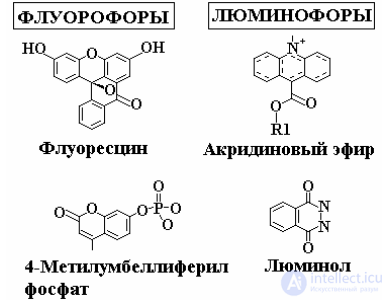
По химической природе люминофоры разделяются на неорганические (фосфо́ры), большинство из которых относится к кристаллофосфо́рам, и органические (органолюминофоры). Свечение неорганических люминофоров (кристаллофосфоров) обусловлено в большинстве случаев присутствием посторонних катионов, содержащихся в малых количествах (от 0,0001 % до 2 %).
Такие примеси (активаторы) обычно являются ионами переходных металлов, например, люминесценция сульфида цинка активируется примесью ионов меди.
Люминесценция — нетепловое свечение вещества, происходящее после поглощения им энергии возбуждения. Впервые люминесценция была описана в XVIII веке.
Один из видов люминесценции, хемилюминесценция (свечение в результате химической реакции), наблюдался впервые в 1669 году Хеннигом Брандом, открывшим фосфор.
До ХХ века теоретические представления о сущности хемилюминесценции, сходились на том, что часть выделяющейся при химической реакции энергии не превращается в теплоту; атомы реагирующих веществ переходят при этом в возбужденное состояние, проявляющееся в свечении.
В ХХ веке Каутский и Цохер в работе над ненасыщенными соединениями кремния обнаружили, что при действии света на них происходит очень яркое явление хеми-, катодо- и фотолюминесценции (фосфоресценции и флюоресценции). Ученые обнаружили, что при охлаждении происходит усиление люминесценции, что навело их на мысль о том, что источником хемилюминесценции могут быть те же объекты, которые вызывают флюоресценцию, то есть атомы вещества, которые не принимают непосредственного участия в химической реакции, а получающие энергию для свечения от прореагировавших частиц.
В 20-х годах ХХ века по инициативе С. И. Вавилова начались исследования, направленные на создание люминесцентных ламп, новых для того времени источников света. В то же время О. В. Лосевым была обнаружена электролюминесценция, впоследствии, использующаяся в производстве светодиодов.
С начала 90-х годов помимо традиционных явлений люминесценции (газового разряда, фотолюминесценции, инжекционной и полевой электролюминесценции, низко- и высоковольтовой катодолюминесценции) началось исследование катодолюминесценции в среднем диапазоне энергий электронного пучка.
В настоящее время явление люминесценции активно используется в создании люминесцентных ламп и светодиодов, в люминофорных экранах для медицинского оборудования, в цветных экранах телевизоров и других электронных приборов, в дизайне, а также в системе безопасности и эвакуации.
С каждым годом технологии производства люминесцирующих веществ совершенствуются, что помогает создавать люминофоры с улучшенными световыми качествами.
Список веществ, способных создавать свечение под тем или иным воздействием достаточно обширен, и поэтому существует несколько видов классификаций данных соединений. Классификация по методу возбуждения является наиболее удобной, поэтому во многих книгах о люминофорах используют именно ее.
| Способ возбуждения люминесценции | Вид люминофоров |
|---|---|
| УФ излучением | Фотолюминофор |
| Пучком электронов | Катодолюминофор |
| Электрическим полем | Электролюминофор |
| α-, β- излучением радиоактивных волн | Радиолюминофоры |
| Рентгеновским или γ- излучением | Рентгенолюминофор |
| Вид люминесценции | Вид поглощаемой энергии |
|---|---|
| Фотолюминесценция | Электромагнитное излучение (УФ, видимое) |
| Рентгенолюминесценция | Электромагнитное излучение (рентгеновское) |
| Катодолюминесценция | Кинетическая энергия электронов |
| Электролюминесценция | Энергия электрического поля |
| Радиолюминесценция | Энергия α-, β-, γ- лучей, ионов |
| Хемилюминесценция | Энергия химической реакции |
| Биолюминесценция | Энергия биохимической реакции |
| Триболюминесценция | Механическая энергия трения |
| Термолюминесценция | Тепловая энергия |
| Характер | Люминофор |
|---|---|
| Внутрицентровой | Используется непроводящий люминофор с, или люминофор с дискретными центрами |
| Рекомбинационный | Используется фотопроводящий люминофор |
| Вид люминесценции | Временная характеристика |
|---|---|
| Флюоресценция | Быстро затухающая |
| Фосфоресценция | Длительная |
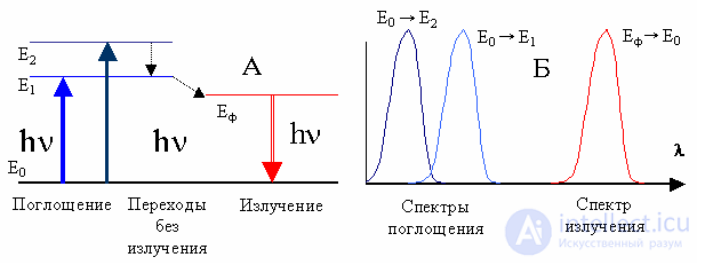
Важная характеристика люминофоров — спектры поглощения, отражающие зависимость величины поглощаемой энергии от длины волны падающего на люминофор света. Спектр излучения люминофора зависит от химической природы активатора и основы люминофора, их взаимодействия, а в случае люминофоров с несколькими активаторами и от взаимодействия активаторов между собой. Спектры излучения могут зависеть от интенсивности и длины волны возбуждающего света, а также от температуры.
Зависимость спектров излучения от длины волны возбуждающего света может быть хорошо прослежена на характеристических люминофорах (Ca, Mg)3(PO4)2·Sn и (Ca, Zn)3(PO4)2·Sn. Их спектры излучения состоят из широких полос, расположенных в красной и зеленой областях спектра.
Количество веществ, которые можно использовать для синтеза люминофоров достаточно велико, однако на практике используются следующие классы соединений: халькогениды и фосфаты металлов второй группы, силикаты, оксиды, вольфраматы, соединения редкоземельных элементов.
Технология изготовления люминофоров относится к высокотемпературному тонкому неорганическому синтезу. Люминофоры используют в виде поликристаллических порошков, реже в виде монокристаллов и тонких пленок. Синтез люминофоров производят при 900—1200ºС.
Для получения люминофора с заданными свойствами необходимо строго соблюдать состав шихты и условия прокаливания, не допускать попадания случайных примесей, обеспечить тщательную сушку люминофора. Также необходимо соблюдать чистоту материалов на всех этапах синтеза.
Халькогениды элементов второй группы
Почти все халькогениды представляют собой фотополупроводниковые соединения с электронным типом проводимости (примесь имеет валентность большую, чем чистый полупроводник, появляются свободные электроны). Для теллурида цинка характерна дырочная проводимость (примесь имеет меньшую валентность, чем чистый полупроводник, появляются разрывы связей — дырки), а для теллурида кадмия дырочная и электронная.
Халькогенидам цинка и кадмия присуща «самоактивированная» люминесценция, обусловленная собственными дефектами, либо ассоциатами с примесью галогенов или трехвалентных катионов. Также для халькогенидов характерна люминесценция, связанная с введением активирующих примесей.
Люминофоры на основе сульфидов щелочноземельных металлов синтезируют прокаливанием смесей соответствующих карбонатов с активатором, серой, плавнями и восстановителем. Основная реакция, которая протекает при синтезе люминофоров может быть представлена уравнением :
Сульфид цинка можно получить сероводородным методом по реакции:
Также следует упомянуть тиосульфатный метод получения сульфидов, основанный на реакциях, которые могут быть упрощенно записаны как:
При синтезе халькогенидных люминофоров исходные сульфиды получают заранее. Синтез происходит в 3 этапа:
Приготовление шихты
На технических весах взвешивают нужное количество халькогенида (порошок) и добавляют к нему заданное количество растворов плавня (вещество, добавляемое к руде при ее плавке для увеличения плавкости имеющихся в ней примесей и образования шлаков) и активатора (вещество, интенсифицирующее физические и химические процессы). Шихта (исходная смесь, использующаяся в пирометаллургических или иных высокотемпературных процессах) тщательно перемешивается.
Сушка
Шихта высушивается при 100—120ºС в сушильном шкафу до пыления в течение времени зависящего от количества шихты (примерно 0,5-1 час).
Прокаливание
Прокаливание проводится в муфельной печи при заданной температуре 900—1200ºС в течение времени, зависящего от количества шихты (около 0,5-1 часа). На стадии прокаливания шихты происходит процесс образования люминофора, то есть кристаллизация основного вещества, диффузия введенных в шихту активирующих примесей, гетерогенные химические и межкристаллические реакции образования в решетке различных дефектов.
Селениды цинка и кадмия получают из сульфидов по реакции, которая в упрощенном виде выглядит так:
Фосфаты металлов второй группы
Среди фосфатов наиболее широкое применение в производстве люминофоров находит фосфат кальция, который используется для люминесцентных источников света. Разнообразие люминесцентных свойств фосфатов заключается в наличии у них большого количества полиморфных модификаций, относительной рыхлостью решеток, которые создают благоприятные условия для формирования люминофора. Также для синтеза люминофоров используют фосфат цинка, который является основой для синтеза катодолюминофоров с красным излучением. Двойные фосфаты кальция и магния используют для синтеза люминофоров, которые впоследствии применяют в лампах ультрафиолетового излучения.
Фосфаты в твердой фазе можно синтезировать по-разному. Например, фосфаты кальция и стронция получаются по одному из следующих вариантов:
Силикаты
Самое большое распространение в производстве силикатных люминофоров получил силикат цинка, использующийся как основа для катодолюминофоров с зеленым свечением. Благодаря высокой химической и термической стойкости, стабильности к электронной бомбардировке, силикатные люминофоры используются в электронно-лучевых приборах. Силикат цинка готовят прокаливанием смеси ZnO c SiO2 при 1200º.
Силикат кальция, активированный Pb и Mn может быть получен путем прокаливания смеси карбонатов или окислов соответствующих металлов с SiO2. Для этого требуется температура в 1150º и атмосфера водяного пара, который оказывает минерализующее действие (превращение в твердое состояние).
Оксидные системы
Многие металлы II, III, IV групп периодической системы обладают люминесценцией при фото-, катодном и рентгеновском возбуждении, но практическое применение имеют немногие. Наиболее широкое применение получил оксид цинка, использующийся в качестве катодолюминофора с очень коротким послесвечением, а также в низковольтных катодолюминофорных индикаторах.
В качестве основы для синтеза катодолюминофоров все более широкое применение имеют оксиды и оксисульфиды редкоземельных элементов (РЗЭ). Их существенным преимуществом является большая насыщенность цвета и высокая стабильность к электронной бомбардировке.
Вольфраматы
Вольфраматные люминофоры в основном относятся к самоактиворованным, то есть люминесцируют без введения активатора.
Соединения редкоземельных элементов
Соединения РЗЭ успешно играют роль, как основного вещества, так и активатора. Такие соединения используются в синтезе катодолюминофоров, работающих при высоких плотностях тока электронного возбуждения.
Использование люминофоров в технике позволяет нам экономить на электроэнергии, так как развитие полупроводниковой техники стимулировало работы по созданию инжекционных электролюминесцентных источников освещения. Возможность смотреть телевизор предоставляется благодаря люминофорам, ведь для экранов приемных телевизионных трубок практикуется использование смесей люминофоров для получения высокой яркости свечения близкого к белому. Применение люминофоров в медицинской отрасли позволяет делать рентген и флюорографию. А также способность люминофоров светиться без электрического источника энергии нашла применение в системах эвакуации и пожарной безопасности.
Неорганические люминофоры применяют в люминесцентных лампах, электронно-лучевых трубках, для изготовления рентгеновских экранов, служат индикаторами радиации и др.
Органические люминофоры (иногда их называют «люмогены») применяют для изготовления ярких флуоресцентных красок для окрашивания текстиля, пластмасс, украшений, в типографских красках, для пигментации полимерной глины, красок для обоев, пигментов для татуировки, косметики, люминесцирующих материалов, используют для выявления трещин в деталях, чувствительном люминесцентном анализе в химии, биологии, медицине и криминалистике.
Исследование, описанное в статье про люминофор, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое люминофор, люминесценция, фосфоресценция и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Прикладная физика
Комментарии
Оставить комментарий
Прикладная физика
Термины: Прикладная физика