Лекция
Привет, Вы узнаете о том , что такое белковый микрочип, Разберем основные их виды и особенности использования. Еще будет много подробных примеров и описаний. Для того чтобы лучше понимать что такое белковый микрочип, днк-микрочип , настоятельно рекомендую прочитать все из категории Биологическое моделирование искусственного интеллекта.
днк-микрочип , или ДНК-чип (англ. DNA microarray) — технология, используемая в молекулярной биологии и медицине. ДНК-микрочип представляет собой множество небольших одноцепочечных молекул — ДНК-зондов, которые ковалентно пришиты к твердому основанию . Каждый такой зонд имеет строго определенную последовательность нуклеотидов и место на микрочипе. Одинаковые зонды располагаются вместе, образуя сайт микрочипа. Между сайтом и последовательностью ДНК зонда есть взаимно-однозначное соответствие. ДНК-микрочипы используются для определения ДНК или РНК (обычно после обратной транскрипции), которые могут быть как белок-кодирующими, так и не кодировать белки. Измерение генной экспрессии посредством кДНК называется профилем экспрессии, или экспрессионным анализом. На современных микрочипах можно полностью расположить целый геном, каждый известный ген которого будет являться зондом .
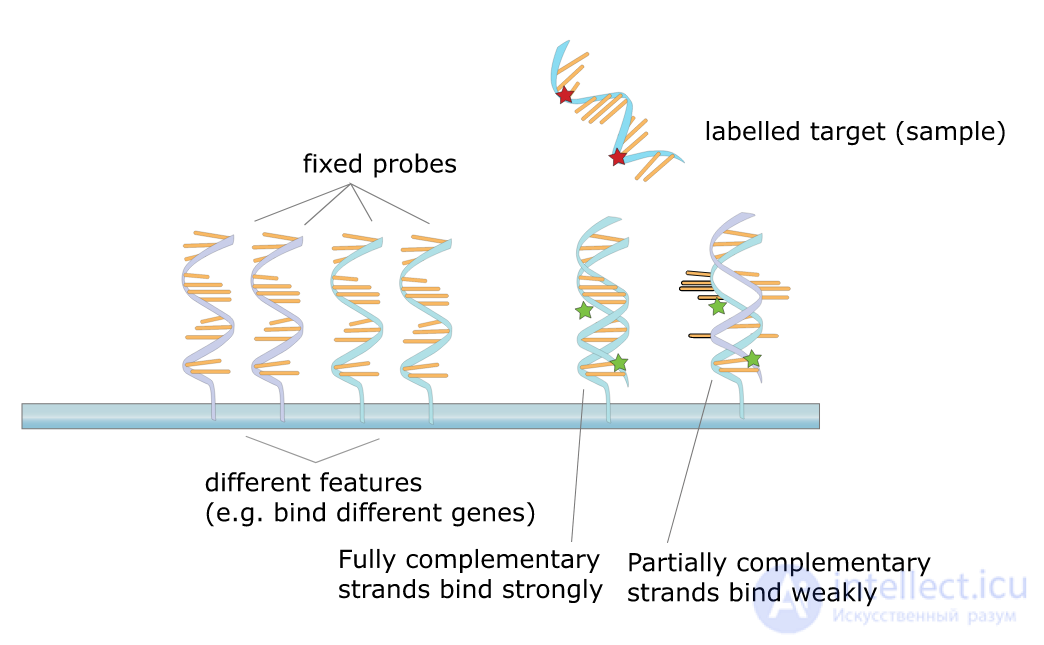
В основе работы ДНК-микрочипов лежит явление гибридизации. При наличии небольших количеств ДНК исследуемого образца осуществляют амплификацию. Для РНК сначала осуществляется обратная транскрипция, что впрочем необязательно: существуют чипы, работающие как с ДНК, так и с РНК. Проверка образцов ДНК/РНК заключается в мечении образцов различными флуоресцентными метками для последующего обнаружения и нанесении образцов на микрочип. ДНК-микрочип с нанесенным на него образцом инкубируют некоторое время, чтобы произошла гибридизация комплементарных одноцепочечных молекул, после чего чип промывают. Все некомплементарные ДНК/РНК образца смываются с чипа. После этого производят сканирование микрочипа при помощи лазера, который вызывает флуоресценцию меченных молекул образца. Подключенный к компьютеру микроскоп оценивает флуоресценцию каждого сайта ДНК-микрочипа, а следовательно и устанавливает последовательности гибридизованных ДНК, что позволяет установить последовательность ДНК,РНК из образца .
Технология ДНК-микрочипов берет начало от Саузерн-блоттинга — методики, в которой фрагментированную ДНК переносят на подходящий носитель и затем с помощью зонда с известной нуклеотидной последовательностью определяют содержание целевой последовательности в образце. Впервые набор различных ДНК, объединенных в чип, был использован в 1987 году для определения особенностей регуляции экспрессии генов интерферонами . Ранние ДНК-микрочипы были сделаны путем «раскапывания» микроколичеств кДНК на фильтровальную бумагу. Использование миниатюрных чипов для определения особенностей экспрессии генов было осуществлено в 1995 году и полный эукариотический геном (Saccharomyces cerevisiae) был размещен на микрочипе в 1997 году.
Амплифицированные фрагменты ДНК при помощи микроманипулятора наносят на кремниевые или стеклянные пластины, ковалентно закрепляя зонды. В 1991—1993 годах был предложен другой подход, в основе которого лежала технология фотолитографии, используемая в полупроводниковой индустрии. Позже, в 1997 году, был запатентован еще один метод — «электрофокусирование»
Сборка начинается с нанесения на стеклянную пластинку размером 12,8×12,8 мм специального защитного фоточувствительного слоя, который делает саму пластинку инертной. Только те места, где защитный слой будет освещен, способны присоединить дезоксирибонуклеотиды (A, T, G, C). После воздействия света на пластинку наносится раствор одного из оснований. Все остальные места защищены специальной фотолитографической маской, таким образом, дезоксирубонуклеотиды ковалентно присоединяются к пластинке в точно нужных местах, после чего все, что не смогло связаться — смывается. Сами нуклеотиды химически модифицированы так, чтобы они могли связать другой нуклеотид только при воздействии света . Многократно повторяя циклы маски — освещения — нанесение нуклеотида — промывания столько раз сколько необходимо и постоянно меняя маски можно добиться создания уникальных последовательностей. Различные маски разрабатывают для создания чипа, в соответствии с требованиями к получаемым зондам .
Цепи одинаковых одноцепочных ДНК, организованные в квадрат 90х90 мкм, растут на поверхности пластины нуклеотид за нуклеотидом. Каждый квадрат в итоге содержит миллиарды идентичных зондов. Сейчас фотолитографию используют для создания относительно коротких зондов, длиной не более 100 нуклеотидов. При этом количество масок, сменяемых за время сборки такого чипа сопоставимо с длиной зондов: так, для сборки зондов длиной 18-25 нуклеотидов на чипе потребуется порядка 40 масок. На практике большое число идентичных ДНК-микрочипов изготавливаются вместе на большой стеклянной подложке .
Сборка такого рода микрочипов требует особенно сложных подложек, представляющих собой по сути электронные чипы, со множеством выходов, каждый из которых контролирует напряжение на определенном месте пластинки. В отличие от фотолитографии, где зонды собираются основание за основанием, здесь уже готовые одноцепочечные олигонуклеотиды доставляются к нужным местам пластинки под действием электрического поля. В нужном месте пластинки при помощи соответствующего выхода микрочипа создается положительное напряжение. Отрицательно заряженная одноцепочечная ДНК движется к созданному положительному заряду и прикрепляется в нужном месте. После этого активируется следующий выход микрочипа, давая положительный заряд в другом месте пластинки, куда и направляется следующий зонд. Плотность расположения ДНК на такого рода рода чипах гораздо меньше чем на чипах, полученных при помощи фотолитографии .
Существует три базовых типа микрочипов: для анализа генной экспрессии (GEM-microarray), для сравнительной геномной гибридизации (MCGH) и для обнаружения единичных нуклеотидных полиморфизмов (SNPM) . Базовый протокол может быть представлен в следующем виде :
1. Выделение ДНК/РНК
На этом этапе выделяется либо мРНК (GEM), либо фрагменты геномной ДНК (MCGH, SNPM) из интересующих образцов. Сейчас это легко осуществляется специальными коммерческими наборами.
2. Мечение ДНК/РНК
Этот процесс начинается с обратной транскрипции (если необходимо). Затем производят амплификацию целевого фрагмента при помощи полимеразной цепной реакции. В процессе ПЦР в состав фрагментов ДНК включаются нуклеотиды с флуоресцентными метками
3. Гибридизация
Здесь флуоресцентно-меченные амплифицированные образцы используются как мишени, для поиска на микрочипе комплементарных цепей, то есть способных образовывать прочные двойные цепи — дуплексы, по правилу комплементарности. Об этом говорит сайт https://intellect.icu . Как пример, комплементарные последовательности 5'-GCATGCAT-3’ и 3’-CGTACGTA-5’. Так как одна из цепей образуемого дуплекса меченая, то сигнал от такого дуплекса можно зарегистрировать.
4. Промывка
Как только заканчивается гибридизация, чип вынимают из раствора, содержащего образцы меченой ДНК. Сам чип потом тщательно промывается по определенным методикам, используя различные буферные смеси, центрифугирование и так далее[10].
5. Сканирование
Этот процесс предполагает использование оптических сканирующих проборов, способных детектировать фотоны с точно определенной длинной волны. Каждый сайт чипа освещается пучком света определенной длины волны, что активирует флуоресцентую метку. «Просвечивание» микрочипа производят аргоновыми лазерами. Активированная флуоресцентная метка испускает фотон чуть большей длины волны, который регистрирует прибор. Чем больше фотонов при одном засвете уловит прибор, тем выше интенсивность свечения данной точки, а значит там большое число образовавшихся дуплексов.
6. Анализ данных
Данные — массив значений интенсивности свечения каждого конкретного сайта микрочипа. Используя математические методы сравнения, можно достоверно установить сайты чипа, где произошла гибридизация, а значит и узнать последовательность ДНК/РНК из образца
Это самое частое применение ДНК-микрочипов. РНК, выделенная из культуры клеток, подвергается обратной транскрипции, в результате которой получается меченная кДНК. Иногда требуется еще один этап транскрипции с кДНК (для чипов, работающих с РНК), при котором создается меченная кРНК. Существует несколько различных способов внести метки в целевую молекулу: включение флуоресцентно меченных нуклеотидов в процессе синтеза кДНК или кРНК, использование биотин-модифицированных нуклеотидов, которые потом окрашиваются флуоресцентно-меченным стрептавидином, использование во время синтеза модифицированных нуклеотидов, на которые затем можно добавить флуоресцентную метку[14].
Меченная таким образом ДНК или РНК гибридизуется на микрочипе, после чего смывается. В каждой точке чипа детектируется флуоресцентный сигнал. В случае с биотинилированными образцами ДНК-микрочип после гибридизации окрашивается стрептавидином, содержащим флуоресцентые метки. Флуоресценция возбуждается светом лазера и регистрируется, как правило, сканирующим конфокальном микроскопом[15].
Микрочипы также используются вместе с иммунопреципитацией хроматина для определения сайтов связывания транскрипционных факторов(ТФ) . В экстракт клеточной ДНК добавляют формальдегид, что ведет к образованию ковалентных сшивок между ДНК и белками. После чего ДНК фрагментируется. Нужный ТФ выделяется из смеси при помощи аффинной хроматографии с использованием антител или тэгов, которые вставляются в данный ТФ генно-инженерными методами заранее. После очистки ДНК освобождается от ТФ, амплифицируется, флуоресцентно метится и используется для гибридизации на микрочипе. Такая техника широко известна как «ChIP-chip»[18], или иммунопреципитация хроматина на микрочипе, но у нее есть ограничения в связи с тем, что ТФ могут связываться далеко от регулируемого ими гена.
ДНК-микрочипы широко используются для выявления однонуклеотидных полиморфизмов (SNP). Существует несколько различных подходов[:
Аллельная дискриминация
На микрочипах располагаются короткие зонды (25 нуклеотидов для микрочипов Affymetrix), содержащие все варианты SNP в центре, так как эта позиция наиболее сильно влияет на качество гибридизации. Фрагментированная, амплифицированная, флуоресцентно-меченная ДНК образца наносится на микрочип, где происходит гибридизация образца и зонда. В местах полной комплементарности молекул регистрируется сильный сигнал[19].
«Golden Gate» анализ
В основе этого метода лежит полимеразная цепная реакция. В раствор геномной ДНК помещаются молекулы комплементарные геномной ДНК и на 3'-конце содержащие различные модификации SNP, а на 5'-конце различные праймеры для последующего проведения ПЦР, кроме того добавляется и комплементарная другой цепи геномной ДНК молекула с другой стороны от SNP, содержащая на 5'-конце еще один праймер для ПЦР. Полимераза будет осуществлять синтез только с того праймера, 3'-конец которого соответствует SNP. В итоге в зависимости от того, с какого праймера с видоизмененным 3'-концом произойдет ПЦР, такой SNP и наблюдается в образце[20].
Расширение праймеров
Здесь зонды подобраны так, что покрывают весь участок ДНК прямо до SNP, не включая полиморфизм. Фрагментированная геномная ДНК гибридизуется с таким чипом, после чего в раствор добавляется полимераза и флуоресцентно-меченные нуклеотиды с 4 различными метками на 3'-конце. Подобные нуклеотиды могут присоединиться полимеразой к имеющейся цепи, но потом присоединить к себе следующий нуклеотид не могут. В итоге зонды расширяются на один нуклеотид, который и соответствует SNP[21].
Оценка крайнего нуклеотида
Этот метод схож с методом расширения праймеров, с тем отличием, что зонды располагаются не на плоской подложке, а на множестве мелких шариков. SNP также распознается по цвету метки единственного достроенного нуклеотида[22].
Несмотря на достоинства ДНК-микрочипов, у них есть и ограничения в применении. Предполагается, что интенсивность сигнала (свечения), зарегистрированная в конкретном сайте микрочипа, линейно зависит от количества ДНК, которое прошло гибридизацию, что не всегда так: из-за кинетики гибридизации уровень сигнала, полученный в данной точке, не является линейной функцией от концентрации данной ДНК в образце. Таким образом, точно оценивать количество ДНК в образце можно лишь в определенном диапазоне изначальных концентраций ДНК, которые все же могут обеспечить линейную зависимость. Оценка относительно изначально больших или малых концентраций ДНК образца будет неточной[15].
В сложных геномах эукариот, особенно млекопитающих, встречается множество гомологичных генов, последовательности которых очень сходны, что накладывает дополнительные условия на дизайн зондов для микрочипов[23][24]. Зонд, сконструированный для одного гена A, может также «поймать на себя» еще и гены B, C, D, оказавшиеся гомологичными гену A, что исказит итоговую картину.
Еще одно ограничение связано с объемом базы известных генов. Невозможен синтез зонда, соответствующего неизвестному гену, и никакие взаимодействия таких генов не могут быть обнаружены. Эта проблема особенно актуальна для прокариот, так как геномы даже близкородственных организмов могут значительно отличаться. Например, у вида бактерий Aggregatibacter actinomycetemcomitans геномы различных штаммов могут различаться на 20% генов и, следовательно, микрочипы, сконструированные под один штамм, не смогут обнаружить другой
Белковый микрочип - технология, применяющаяся в молекулярной биологии. Белковый микрочип представляет собой твердую подложку(основание), на которую ковалентно пришиваются тысячи различных белков(антигены, антитела, ферменты и т.д.) в различных точках микрочипа. Каждый отдельный белок формирует область своей высокой концентрации на микрочипе. Данная технология очень схожа с технологией ДНК-микрочипа, только в качестве зондов выступают не молекулы одноцепочной ДНК, а белки.
В настоящее время относительно широко используются три типа белковых микрочипов: аналитические, функциональные и обратно-фазовые микрочипы.

Данные микрочипы обычно используются для профилирования сложной смеси белков: измерения сродства, специфичности, уровня экспрессии белка в смеси. В данной методике библиотеки антител, аптамеров, антигенов наносятся на твердые подложки, составляющие основу микрочипа. Далее такой чип погружается в белковую смесь, для которую надо профилировать. Белковые микрочипы с использованием антител были наиболее распространенными в 00-х годах 21 века. Аналитические микрочипы могут быть использованы для поисков дифференциальной экспрессии и в клинической диагностике. В качестве примера можно привести сравнение здоровых и больных тканей, а также ответ ткани на изменение условий окружающей среды
Данный тип микрочипов отличается от аналитических тем, что на твердом основании располагаются полностью функциональные белки или домены, а не аналитическая триада (антитела, аптамеры, антигены). Такие микрочипы позволяют анализировать биохимическую активность целого протеома в единственном эксперименте. Кроме того используются для изучения многочисленных взаимодействий белков с другими белками, ДНК, РНК, липидами, низкомолекулярными лигандами
При изготовлении микрочипов данного типа клетки, изолированные из разных тканей подвергаются лизису. Лизат наносится на нитроцеллюлозную мембрану при помощи специальной машины - формируя микрочип, Затем каждая ячейка полученного микрочипа анализируется разными антителами против интересующего белка. Данный тип микрочипов позволяет обнаружить белки, или их конформационные изменения, которые появляются только во время определенных болезней
Аналитические микроматрицы также известны как матрицы захвата. В этом методе библиотека антител, аптамеров или аффител размещается на поверхности носителя. Они используются в качестве молекул захвата, поскольку каждая специфично связывается с определенным белком. Массив исследуют сложным белковым раствором, таким как клеточный лизат.. Анализ результирующих реакций связывания с использованием различных систем обнаружения может предоставить информацию об уровнях экспрессии определенных белков в образце, а также измерения аффинности и специфичности связывания. Этот тип микроматрицы особенно полезен для сравнения экспрессии белков в различных растворах. Например, ответ клеток на конкретный фактор может быть идентифицирован путем сравнения лизатов клеток, обработанных конкретными веществами или выращенных в определенных условиях, с лизатами контрольных клеток. Другое применение - идентификация и профилирование пораженных тканей.Существует три типа белковых микрочипов, которые в настоящее время используются для изучения биохимической активности белков.
Белковые микроматрицы с обращенной фазой (RPPA) включают сложные образцы, такие как лизаты тканей. Клетки выделяют из различных представляющих интерес тканей и лизируют. Лизат наносят на микрочип и исследуют антителами против целевого белка, представляющего интерес. Эти антитела обычно обнаруживаются с помощью хемилюминесцентных , флуоресцентных или колориметрических анализов. Эталонные пептиды напечатаны на предметных стеклах, чтобы можно было количественно определить содержание белка в образцах лизатов. RPA позволяют определить присутствие измененных белков или других агентов, которые могут быть результатом заболевания. В частности, посттрансляционные модификации, которые обычно изменяются в результате заболевания, могут быть обнаружены с помощью RPA
Функциональные белковые микрочипы (также известные как целевые белковые массивы) конструируются путем иммобилизации большого количества очищенных белков и используются для идентификации взаимодействий белок-белок, белок-ДНК, белок- РНК , белок- фосфолипид и белок-мелкие молекулы, чтобы оценить ферментативную активность и выявить антитела и продемонстрировать их специфичность. Они отличаются от аналитических массивов тем, что функциональные белковые массивы состоят из массивов, содержащих полноразмерные функциональные белки или белковые домены. Эти протеиновые чипы используются для изучения биохимической активности всего протеома в одном эксперименте.
Ключевым элементом любого функционального анализа на основе микроматрицы белков является то, что белки в матрице должны сохранять свою природную структуру, чтобы на поверхности матрицы могли иметь место значимые функциональные взаимодействия. Преимущества контроля точного способа прикрепления к поверхности с помощью подходящей аффинной метки заключаются в том, что иммобилизованные белки будут иметь гомогенную ориентацию, что приведет к более высокой удельной активности и более высокому отношению сигнал / шум в анализах с меньшим вмешательством из-за отсутствия помех. конкретные взаимодействия. [
Методы обнаружения белкового массива должны давать высокий сигнал и низкий фон. Наиболее распространенным и широко используемым методом обнаружения является флуоресцентная маркировка, которая отличается высокой чувствительностью, безопасностью и совместима с легко доступными лазерными сканерами на микрочипах. Могут использоваться другие метки, такие как аффинные, фотохимические или радиоизотопные метки. Эти метки прикреплены к самому зонду и могут мешать реакции белка-мишени. Таким образом, доступен ряд методов обнаружения без меток, таких как поверхностный плазмонный резонанс (SPR), углеродные нанотрубки, датчики с углеродными нанопроводами (где обнаружение происходит через изменение проводимости) и кантилеверы микроэлектромеханической системы (MEMS). [17]Все эти методы детектирования без меток являются относительно новыми и еще не подходят для детектирования взаимодействия белков с высокой пропускной способностью; тем не менее, они обещают многообещающее будущее. Иммуноанализы на микропиллярных каркасах из тиол-еновой «синтетической бумаги» показали, что они генерируют превосходный сигнал флуоресценции. [18]
Для количественного определения белка на предметных стеклах, покрытых нитроцеллюлозой, можно использовать флуоресцентное детектирование в ближнем ИК-диапазоне. Это ограничивает помехи из-за автофлуоресценции нитроцеллюлозы на длинах волн УФ, используемых для стандартных флуоресцентных датчиков. [19]
Существуют пять основных областей, в которых применяются белковые матрицы: диагностика, протеомика, функциональный анализ белков, характеристика антител и разработка методов лечения.
Диагностика предполагает обнаружение антигенов и антител в образцах крови; профилирование сывороток для обнаружения новых биомаркеров болезней ; мониторинг болезненных состояний и реакции на терапию в персонализированной медицине; мониторинг окружающей среды и продуктов питания. Цифровой биоанализ является примером использования белковых микрочипов в диагностических целях. В этой технологии массив микролунок на стеклянном / полимерном чипе засевается магнитными шариками (покрытыми флуоресцентными мечеными антителами), подвергается воздействию антигенов-мишеней и затем охарактеризован под микроскопом посредством подсчета флуоресцентных лунок. Недавно была продемонстрирована экономически эффективная платформа для изготовления (с использованием полимеров OSTE ) таких решеток микролунок, и была успешно охарактеризована модельная система биологических анализов.[20]
Протеомика относится к профилированию экспрессии белков, то есть к тому, какие белки экспрессируются в лизате конкретной клетки.
Функциональный анализ белков - это идентификация белок-белковых взаимодействий (например, идентификация членов белкового комплекса), белок-фосфолипидных взаимодействий, низкомолекулярных мишеней, ферментативных субстратов (особенно субстратов киназ ) и лигандов рецепторов.
Характеристика антител характеризует перекрестную реактивность , специфичность и картирование эпитопов .
Разработка лечения включает разработку антиген-специфических методов лечения аутоиммунных заболеваний , рака и аллергии; идентификация малых молекул-мишеней, которые потенциально могут быть использованы в качестве новых лекарств.
Несмотря на значительные инвестиции, сделанные несколькими компаниями, протеиновые чипы еще не наводнили рынок. Производители обнаружили, что с белками на самом деле довольно сложно работать. Производство надежных, последовательных, высокопроизводительных белков, которые правильно сложены и функциональны, сопряжено с трудностями, поскольку они часто приводят к низкому выходу белков из-за пониженной растворимости и образования телец включения. [ необходима цитата ] Для создания белкового чипа требуется гораздо больше шагов, чем для создания ДНК-чипа .
Существует ряд подходов к этой проблеме, которые фундаментально различаются в зависимости от того, иммобилизуются ли белки посредством неспецифических, плохо определенных взаимодействий или посредством определенного набора известных взаимодействий. Первый подход привлекателен своей простотой и совместим с очищенными белками, полученными из нативных или рекомбинантных источников [21] [22], но страдает рядом рисков. Наиболее заметные из них связаны с неконтролируемым характером взаимодействий между каждым белком и поверхностью; в лучшем случае это могло бы дать начало гетерогенной популяции белков, в которых активные центры иногда перекрываются поверхностью; в худшем случае он может полностью уничтожить активность из-за частичного или полного поверхностно-опосредованного разворачивания иммобилизованного белка.
Проблемы включают: 1) поиск поверхности и метода прикрепления, который позволяет белкам сохранять свою вторичную или третичную структуру.и, следовательно, их биологическая активность и их взаимодействия с другими молекулами, 2) создание массива с длительным сроком хранения, чтобы белки на чипе не денатурировались в течение короткого времени, 3) идентификация и выделение антител или других молекул захвата против каждого белка в геноме человека, 4) количественное определение уровней связанного белка при обеспечении чувствительности и избегании фонового шума, 5) извлечение обнаруженного белка из чипа для его дальнейшего анализа, 6) снижение неспецифического связывания захватывающими агентами, 7 ) емкость чипа должна быть достаточной для визуализации максимально полного представления протеома; обильные белки подавляют обнаружение менее обильных белков, таких как сигнальные молекулы и рецепторы, которые обычно представляют больший терапевтический интерес.
Исследование, описанное в статье про белковый микрочип, подчеркивает ее значимость в современном мире. Надеюсь, что теперь ты понял что такое белковый микрочип, днк-микрочип и для чего все это нужно, а если не понял, или есть замечания, то не стесняйся, пиши или спрашивай в комментариях, с удовольствием отвечу. Для того чтобы глубже понять настоятельно рекомендую изучить всю информацию из категории Биологическое моделирование искусственного интеллекта
Комментарии
Оставить комментарий
Биологическое моделирование искусственного интеллекта
Термины: Биологическое моделирование искусственного интеллекта