Лекция
оптогенетика - это многогранное исследовательское направление в биологии и нейронауках, которое объединяет генетические методы и оптические технологии для управления активностью нейронов и других клеток с использованием света. Эта область исследования имеет огромное значение для понимания функций нервной системы, а также для разработки методов лечения различных нейрологических и психических расстройств.
Оптогенетика — методика исследования работы нервных клеток, основанная на внедрении в их мембрану специальных каналов — опсинов, реагирующих на возбуждение светом. Если на мозг воздействовать светом с определенной длиной волны, то те нейроны, которые имеют такие каналы, будут активироваться или, наоборот, не смогут генерировать потенциалы действия.
Для экспрессии каналов используются методы генной инженерии, для последующей активации либо ингибирования нейронов и нервных сетей используются лазеры, оптоволокно и другая оптическая аппаратура.
Оптогенетика появилась в 2005 году, а первым использованным опсином стал канальный родопсин 2 (англ. channelrhodopsin-2, ChR2) .
Преимущество оптогенетических методов перед традиционными электрофизиологическими методами изучения нервных сетей и воздействия на них состоит в возможности высокоселективной активации либо подавления конкретных нейрональных связей . Эта селективность открывает новые возможности в терапии болезни Паркинсона, депрессии, тревожности и эпилепсии .
Важные компоненты оптогенетики включают:
Оптогенные методы: В оптогенетике используются оптогенные инструменты, такие как родопсины и хлоридные каналы, которые могут быть введены в нейроны с использованием генной инженерии. Эти инструменты реагируют на свет различных длин волн и могут изменять потенциалы мембраны нейронов.
Генетическая инженерия: Для внедрения оптогенных инструментов в клетки используются методы генетической инженерии, такие как вирусная трансдукция или трансгенные модели, чтобы создать живые организмы с интегрированными оптогенными белками.
Лазеры и световые источники: Для активации оптогенных инструментов требуется свет. Лазеры и световые волокна используются для точной и контролируемой подачи света в определенные области организма.
Применения оптогенетики многообразны. Это включает в себя исследования активности мозга, включая исследование механизмов памяти и обучения, а также поиск подходов к лечению болезней, связанных с нейрологическими расстройствами, например, депрессией, шизофренией и болезнью Паркинсона.
Оптогенетика предоставляет возможность манипулировать активностью клеток с высокой точностью, что делает ее мощным инструментом в исследованиях нейронаук и разработке новых методов лечения нейрологических расстройств.
В 1979 году Фрэнсис Крик предположил, что контроль над всеми клетками одного типа в мозге, оставляя при этом остальные более или менее неизмененными, является настоящей проблемой для нейробиологии. Фрэнсис Крик предположил, что технология, использующая свет, могла бы быть полезна для контроля активности нейронов с временной и пространственной точностью, но в то время не было техники, позволяющей заставить нейроны реагировать на свет.
К началу 1990-х годов Л. К. Кац и Э. Каллауэй показали, что свет может высвободить глутамат. Хеберле и Бюльдт в 1994 году уже продемонстрировали функциональную гетерологичную экспрессию бактериородопсина для светоактивируемого потока ионов в дрожжах.
В 1995 году Георг Нагель и др. и Эрнст Бамберг попробовали гетерологичную экспрессию микробных родопсинов (также бактериородопсина, а также в не-нейронной системе, ооцитах Xenopus) ( Georg Nagel et al., 1995, FEBS Lett.) и продемонстрировали светоиндуцированный ток.
Самый ранний генетически направленный метод, в котором использовался свет для контроля нейронов, сенсибилизированных родопсином, был описан в январе 2002 года Борисом Земельманом и Геро Мизенбеком , которые использовали культивированные родопсин дрозофилы нейроны млекопитающих. В 2003 году Земельман и Мизенбек разработали второй метод светозависимой активации нейронов, в котором отдельные ионотропные каналы TRPV1, TRPM8 и P2X2 закрывались фотоклеточными лигандами в ответ на свет. Начиная с 2004 года группы Крамера и Исакова в сотрудничестве с группой Траунера разработали органические фотопереключатели или соединения с «обратимо замкнутыми клетками» , которые могли взаимодействовать с генетически введенными ионными каналами. Методика TRPV1, хотя и без триггера освещения, впоследствии использовалась несколькими лабораториями для изменения питания, передвижения и поведенческой устойчивости у лабораторных животных. Однако основанные на освещении подходы к изменению активности нейронов не применялись за пределами первоначальных лабораторий, вероятно, потому, что вскоре после этого был клонирован более простой в использовании канальный родопсин.
Питер Хегеманн , изучая световую реакцию зеленых водорослей в Университете Регенсбурга, обнаружил фототоки, которые были слишком быстрыми, чтобы их можно было объяснить классическими родопсинами животных , связанными с g-белком . Объединившись с электрофизиологом Георгом Нагелем из Института Макса Планка во Франкфурте, они смогли продемонстрировать, что единственный ген водоросли Chlamydomonas производит большие фототоки при экспрессии в ооците лягушки. Чтобы идентифицировать экспрессирующие клетки, они заменили цитоплазматический хвост белка водоросли флуоресцентным белком YFP , создав первый широко применимый оптогенетический инструмент. В статье 2003 года они заявили, что «экспрессия ChR2 в ооцитах или клетках млекопитающих может использоваться в качестве мощного инструмента для увеличения цитоплазматической концентрации Ca 2+ или деполяризации клеточной мембраны просто путем освещения».
Карл Дейссерот из факультета биоинженерии Стэнфорда опубликовал в начале июля 2004 года страницы своего первого эксперимента, показывающие световую активацию нейронов, экспрессирующих каналородопсин. [30] В августе 2005 года сотрудники его лаборатории, в том числе аспиранты Эд Бойден и Фэн Чжан , в сотрудничестве с Георгом Нагелем , опубликовали первую демонстрацию однокомпонентной оптогенетической системы в нейронах с использованием каналородопсин-2(H134R). )-eYFP мутант от Георга Нагеля , который является первым мутантом канального родопсина-2 с момента его функциональной характеристики Георгом Нагелем и Хегеманном.
Чжуо-Хуа Пан из Государственного университета Уэйна , исследуя возможность восстановления зрения при слепоте, попробовал направить родопсин в ганглиозные клетки — нейроны в наших глазах, которые напрямую связаны с мозгом. По словам Пана, первое наблюдение Паном оптической активации нейронов сетчатки канальным родопсином было в феврале 2004 года, [32] за пять месяцев до первоначального наблюдения Дейссерота в июле 2004 года . Действительно, трансфицированные нейроны становились электрически активными в ответ на свет, и в В 2005 году Чжуо-Хуа Пан сообщил об успешной трансфекции канального родопсина in vivo в ганглиозных клетках сетчатки мышей и об электрических реакциях на фотостимуляцию в культуре срезов сетчатки. [34] Этот подход в конечном итоге был реализован на пациенте-человеке Ботондом Роской и его коллегами в 2021 году.
В апреле 2005 года Сусана Лима и Мизенбек сообщили о первом использовании генетически направленной фотостимуляции P2X2 для контроля поведения животного. Они показали, что фотостимуляция генетически ограниченных групп нейронов, например, нейронов дофаминергической системы , вызывает характерные поведенческие изменения у плодовых мух.
В октябре 2005 года Линн Ландмессер и Стефан Херлитце также опубликовали информацию об использовании каналороходпсина-2 для контроля активности нейронов в культивируемых нейронах гиппокампа и цепях спинного мозга кур в интактных развивающихся эмбрионах. Кроме того, они впервые представили родопсин позвоночных, светоактивируемый рецептор, связанный с G-белком, в качестве инструмента для ингибирования активности нейронов посредством рекрутирования внутриклеточных сигнальных путей также в нейронах гиппокампа и интактном развивающемся курином эмбрионе.
Группы Александра Готшалка и Георга Нагеля создали первый мутант ChR2 (H134R) и первыми использовали каналродопсин-2 для контроля активности нейронов у интактных животных, показав, что двигательные паттерны у круглых червей C. elegans могут быть вызваны световой стимуляцией генетически отобранные нейронные цепи (опубликовано в декабре 2005 г.). У мышей контролируемая экспрессия оптогенетических инструментов часто достигается с помощью специфичных для типа клеток методов Cre/loxP, разработанных для нейробиологии Джо З. Циеном еще в 1990-х годах [38] для активации или ингибирования определенных областей мозга и типов клеток. в естественных условиях .
В 2007 году лаборатории Бойдена и Дейсерота (совместно с группами Готшалка и Георга Нагеля ) одновременно сообщили об успешном оптогенетическом ингибировании активности нейронов.
В 2007 году группы Георга Нагеля и Хегемана начали оптогенетические манипуляции с цАМФ. В 2014 году Авелар и др. сообщили о первом гене родопсин-гуанилилциклазы гриба. В 2015 году Шейб и др. и Гао и др. охарактеризовали активность гена родопсин-гуанилилциклазы. И Шицян Гао и др. и Георг Нагель , Александр Готшальк идентифицировали его как первый 8 ТМ родопсин.
Мощное влияние оптогенетических технологий на исследования мозга было отмечено многочисленными наградами, присужденными ключевым игрокам в этой области.
В 2010 году Георг Нагель , Петер Хегеманн и Эрнст Бамберг были удостоены премии Уайли в области биомедицинских наук , а также были среди награжденных премией Карла Хайнца Беккурта в 2010 году . [45] В том же году Карл Дейссерот был удостоен премии первая премия HFSP Nakasone за «новаторскую работу по разработке оптогенетических методов изучения функций нейронных сетей, лежащих в основе поведения».
В 2012 году Бамберг, Дейссерот, Хегеманн и Георг Нагель были удостоены премии Цульха от Общества Макса Планка , а Мизенбек был удостоен премии Байе Латура в области здравоохранения за «первопроходство в оптогенетических подходах к манипулированию активностью нейронов и контролю над поведением животных». "
В 2013 году Георг Нагель и Хегеманн были среди награжденных премией Луи-Жанте в области медицины . Также в том же году Бамберг, Бойден, Дейссерот, Хегеманн, Мизенбек и Георг Нагель были совместно награждены Премией мозга за «изобретение и усовершенствование оптогенетики».
В 2017 году Дейссерот был награжден исследовательской премией Эльзы Кренер Фрезениус «за открытия в оптогенетике и химии гидрогелевых тканей, а также за исследования нейронных цепей, лежащих в основе депрессии».
В 2018 году Фонд Инамори вручил Дейссероту Киотскую премию за «возглавление оптогенетики» и «революционные исследования в области системной нейробиологии».
В 2019 году Бамберг, Бойден, Дайссерот, Хегеманн, Мизенбек и Георг Нагель были награждены премией Румфорда Американской академии искусств и наук в знак признания «их выдающегося вклада, связанного с изобретением и усовершенствованием оптогенетики».
В 2020 году Дейссерот был награжден премией Heineken в области медицины от Королевской Нидерландской академии искусств и наук за разработку оптогенетики и химии гидрогелевых тканей.
В 2020 году Мизенбек, Хегеманн и Георг Нагель совместно получили премию Шоу в области наук о жизни и медицины.
В 2021 году Хегеманн, Дейсерот и Дитер Остерхельт получили премию Альберта Ласкера за фундаментальные медицинские исследования .
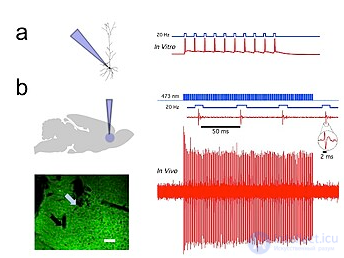
Рис. 1. Каналродопсин-2 (ChR2) индуцирует точную во времени активность синего света в прелимбических префронтальных кортикальных нейронах крысы. а) Схема in vitro (слева), показывающая доставку синего света и целоклеточную пэтч-кламп-запись вызванной светом активности флуоресцентного CaMKllα::ChR2-EYFP, экспрессирующего пирамидный нейрон (справа) в остром срезе мозга. б) Схема in vivo (слева), показывающая доставку синего света (473 нм) и запись единичного устройства. (внизу слева) Корональный срез мозга, демонстрирующий экспрессию CaMKllα::ChR2-EYFP в прелимбической области. Голубая стрелка показывает кончик оптического волокна; черная стрелка показывает кончик записывающего электрода (слева). Белая полоса, 100 мкм . (внизу справа) Световая запись префронтального коркового нейрона in vivo у трансдуцированной крысы CaMKllα::ChR2-EYFP, показывающая вызванное светом всплеск подачи импульсов синего света частотой 20 Гц (справа). Вставка: репрезентативная единичная реакция, вызванная светом. [57]
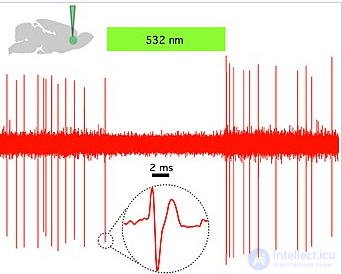
Рис 2 . Галородопсин (NpHR) быстро и обратимо подавляет спонтанную активность in vivo в прелимбической префронтальной коре крыс. (Вверху слева) Схема, показывающая доставку зеленого света (532 нм) in vivo и единичную запись спонтанно активного CaMKllα::eNpHR3.0-EYFP, экспрессирующего пирамидный нейрон. (Справа) Пример кривой, показывающий, что непрерывное освещение с длиной волны 532 нм ингибирует активность отдельных единиц in vivo . Врезка: репрезентативное событие для одного объекта; Зеленая полоса, 10 секунд. [57]
Продолжительность: 45 секунд.0:45
Нематода, экспрессирующая светочувствительный ионный канал Mac. Mac представляет собой протонный насос, первоначально выделенный у гриба Leptosphaeria maculans и теперь экспрессируемый в мышечных клетках C. elegans , который открывается в ответ на зеленый свет и вызывает гиперполяризующее торможение. Следует отметить увеличение длины тела червя каждый раз, когда он подвергается воздействию зеленого света, что предположительно вызвано миорелаксирующим действием Мака. [58]
Нематода, экспрессирующая ChR2 в группе губернакулярно-косых мышц, реагирует на стимуляцию синим светом. Стимуляция синим светом заставляет косые губернакулярные мышцы многократно сокращаться, вызывая повторяющиеся толчки спикулы , что естественно наблюдается во время совокупления. [59]
Оптогенетика обеспечивает временную точность в миллисекундном масштабе, что позволяет экспериментатору идти в ногу с быстрой обработкой биологической информации (например, при исследовании причинной роли определенных паттернов потенциала действия в определенных нейронах). Действительно, чтобы исследовать нервный код, оптогенетика по определению должна работать в миллисекундном масштабе времени, чтобы обеспечить добавление или удаление точных паттернов активности внутри конкретных клеток мозга интактных животных, включая млекопитающих (см. Рисунок 1 ) . Для сравнения, временная точность традиционных генетических манипуляций (используемых для исследования причинной роли конкретных генов внутри клеток посредством изменений «потеря функции» или «приобретение функции» в этих генах) довольно медленная, от нескольких часов до дней. до месяцев. Важно также иметь быстрые показания в оптогенетике, которые могут идти в ногу с оптическим контролем. Это можно сделать с помощью электрических записей («оптродов») или с помощью репортерных белков, которые являются биосенсорами , когда ученые соединяют флуоресцентные белки с белками-детекторами. Кроме того, помимо своего научного воздействия, оптогенетика представляет собой важный пример ценности как экологического сохранения (поскольку многие из ключевых инструментов оптогенетики возникают из микробных организмов, занимающих специализированные экологические ниши), так и важности чистой фундаментальной науки, поскольку эти опсины были изучались на протяжении десятилетий биофизиками и микробиологами ради них самих, без учета их потенциальной ценности для понимания нейробиологии и нейропсихических заболеваний. [60]
Светоактивируемые белки: каналы, насосы и ферменты
Таким образом, отличительной чертой оптогенетики является внедрение быстрых, активируемых светом каналов, насосов и ферментов, которые позволяют точно во времени манипулировать электрическими и биохимическими событиями, сохраняя при этом разрешение типов клеток за счет использования специфических механизмов нацеливания. Среди микробных опсинов, которые можно использовать для исследования функции нервной системы, есть каналородопсины (ChR2, ChR1, VChR1 и SFO) для возбуждения нейронов и анионпроводящие каналородопсины для светоиндуцированного торможения. Недавно были созданы калиевые каналы , косвенно управляемые светом, для предотвращения генерации потенциала действия в нейронах во время освещения синим светом. [61] [62] Световые ионные насосы также используются для ингибирования активности нейронов, например галородопсин (NpHR), [63] усиленные галородопсины (eNpHR2.0 и eNpHR3.0, см. рисунок 2), [64] археродопсин (Arch ), грибковые опсины (Mac) и усиленный бактериородопсин (eBR).
Оптогенетический контроль четко определенных биохимических событий в поведении млекопитающих теперь также возможен. Опираясь на предыдущую работу по слиянию опсинов позвоночных со специфическими рецепторами, связанными с G-белком [66], было создано семейство химерных однокомпонентных оптогенетических инструментов, которые позволили исследователям манипулировать у ведущих себя млекопитающих концентрацией определенных внутриклеточных мессенджеров, таких как цАМФ и IP3, в клетках-мишенях. . [67] Вскоре после этого последовали и другие биохимические подходы к оптогенетике (особенно с инструментами, которые проявляли низкую активность в темноте), когда оптический контроль над малыми ГТФазами и аденилатциклазой был достигнут в культивируемых клетках с использованием новых стратегий, разработанных в нескольких различных лабораториях.Фотоактивируемые аденилатциклазы были обнаружены у грибов и успешно использованы для контроля уровня цАМФ в нейронах млекопитающих. Этот новый репертуар оптогенетических актуаторов теперь позволяет специфическому для типа клеток и точному во времени контролю нескольких осей клеточных функций у интактных животных.
Аппаратное обеспечение для легкого применения
Еще одним необходимым фактором является аппаратное обеспечение (например, интегрированные оптоволоконные и твердотельные источники света), позволяющее контролировать определенные типы клеток, даже глубоко внутри мозга, у свободно ведущих себя животных. Чаще всего последнее сейчас достигается с использованием диодной технологии с оптоволоконной связью, представленной в 2007 году, хотя, чтобы избежать использования имплантированных электродов, исследователи разработали способы вписать «окно» из диоксида циркония, которое был модифицирован, стал прозрачным и имплантирован в черепа мышей, чтобы позволить оптическим волнам проникать глубже и стимулировать или подавлять отдельные нейроны. Для стимуляции поверхностных областей мозга, таких как кора головного мозга, оптические волокна или светодиоды можно прикрепить непосредственно к черепу животного. Для доставки света в более глубокие области мозга используются более глубоко имплантированные оптические волокна. [78] В дополнение к оптоволоконным подходам были разработаны полностью беспроводные методы, использующие беспроводную подачу питания к головным светодиодам для беспрепятственного изучения сложного поведения свободно ведущих себя организмов.
Экспрессия оптогенетических актуаторов
Оптогенетика также обязательно включает разработку стратегий генетического нацеливания, таких как клеточно-специфичные промоторы или другие адаптированные условно-активные вирусы, для доставки светочувствительных зондов к конкретным популяциям нейронов в мозге живых животных (например, червей, плодовых мух, мышей). , крысы и обезьяны). У беспозвоночных, таких как черви и плодовые мухи, некоторое количество полностью транс-ретиналя (ATR) поступает с пищей. Как отмечалось выше, ключевым преимуществом микробных опсинов является то, что они полностью функциональны без добавления экзогенных кофакторов у позвоночных.
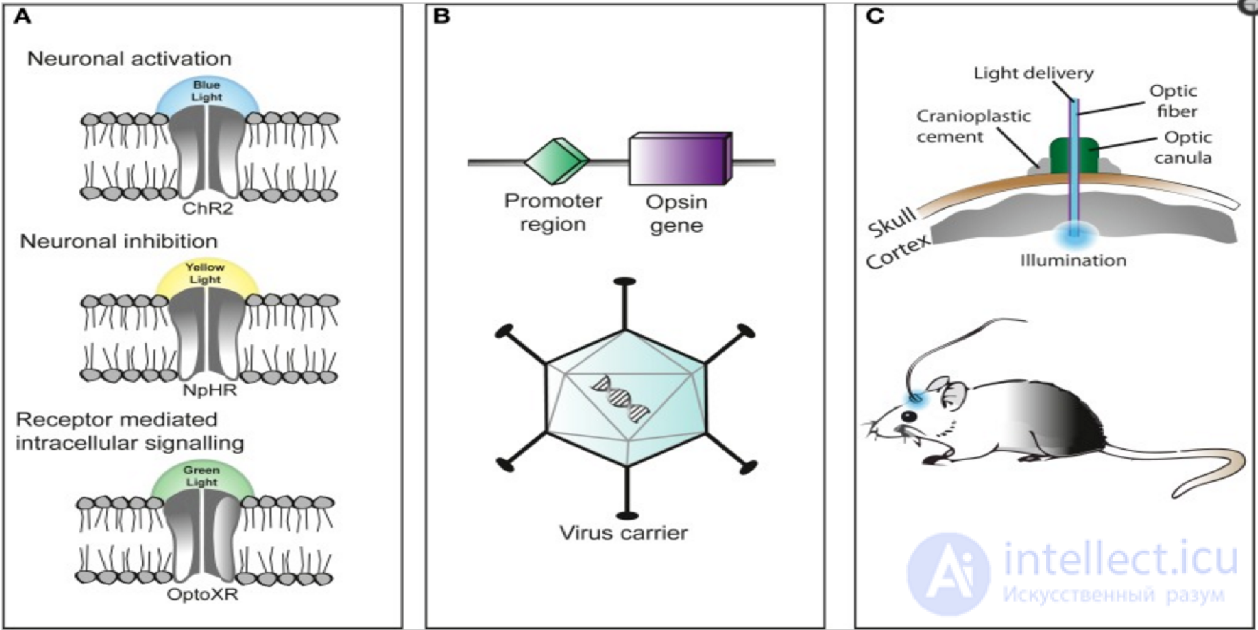
Тремя основными компонентами применения оптогенетики являются следующие: (A) Идентификация или синтез светочувствительного белка (опсина), такого как каналродопсин-2 (ChR2), галородопсин (NpHR) и т. д. (B) Разработка системы для введения генетического материала, содержащего опсин, в клетки для экспрессии белка, например, с помощью рекомбиназы Cre или применения светоизлучающих инструментов с аденоассоциированным вирусом (С) .
Техника использования оптогенетики гибка и адаптируется к потребностям экспериментатора. Катион-селективные каналородопсины (например, ChR2) используются для возбуждения нейронов, анион-проводящие каналородопсины (например, GtACR2) ингибируют активность нейронов. Объединение этих инструментов в единую конструкцию (например, BiPOLES) позволяет осуществлять как торможение, так и возбуждение в зависимости от длины волны освещения.
Введение микробного опсина в определенную подгруппу клеток является сложной задачей. Популярным подходом является введение сконструированного вирусного вектора, содержащего ген оптогенетического актуатора, прикрепленный к специфическому промотору , такому как CAMKIIα , который активен в возбуждающих нейронах. Это обеспечивает некоторый уровень специфичности, предотвращая, например, экспрессию в глиальных клетках.
Более конкретный подход основан на трансгенных мышах-"драйверах", которые экспрессируют рекомбиназу Cre , фермент, катализирующий рекомбинацию между двумя сайтами lox-P, в специфической подгруппе клеток, например, в интернейронах , экспрессирующих парвальбумин . При введении сконструированного вирусного вектора, содержащего ген оптогенетического актуатора, между двумя сайтами lox-P, только клетки, продуцирующие рекомбиназу Cre, будут экспрессировать микробный опсин. Этот метод позволил использовать несколько модифицированных оптогенетических актуаторов без необходимости создавать целую линию трансгенных животных каждый раз, когда необходим новый микробный опсин.
После введения и экспрессии микробного опсина управляемый компьютером источник света должен быть оптически связан с рассматриваемой областью мозга. Часто используются светоизлучающие диоды (LED) или твердотельные лазеры с диодной накачкой по оптоволокну (DPSS). Недавние достижения включают появление беспроводных устройств, крепящихся на голову, которые применяют светодиоды к целевым областям и, как следствие, дают животным больше свободы передвижения.
Подходы на основе волокон также могут использоваться для сочетания оптической стимуляции и визуализации кальция . Это позволяет исследователям визуализировать и манипулировать активностью отдельных нейронов у бодрствующих животных. Также возможна одновременная запись из нескольких глубоких областей мозга с использованием линз GRIN , подключенных через оптическое волокно к внешнему фотодетектору и фотостимулятору.
Одна из основных проблем оптогенетики заключается в том, что не все рассматриваемые клетки могут экспрессировать ген микробного опсина на одном и том же уровне. Таким образом, даже освещение с определенной интенсивностью света будет оказывать различное воздействие на отдельные клетки. Оптогенетическая стимуляция нейронов головного мозга еще менее контролируема, поскольку интенсивность света от источника света (например, имплантированного оптического волокна) падает экспоненциально.
Остается трудным направить опсин в определенные субклеточные компартменты, например, в плазматическую мембрану, синаптические везикулы или митохондрии. Ограничение опсина определенными областями плазматической мембраны, такими как дендриты , соматы или окончания аксонов , обеспечивает более четкое понимание нейронных цепей.
Математическое моделирование показывает, что избирательная экспрессия опсина в определенных типах клеток может радикально изменить динамическое поведение нейронных цепей. В частности, оптогенетическая стимуляция, которая преимущественно нацелена на ингибирующие клетки, может трансформировать возбудимость нервной ткани, влияя также на нетрансфицированные нейроны.
Исходный канал родопсина-2 закрывался медленнее, чем типичные катионные каналы корковых нейронов, что приводило к длительной деполяризации и притоку кальция. С тех пор было создано множество вариантов канального родопсина с более благоприятной кинетикой.
Разница между естественными паттернами спайков и оптогенетической активацией заключается в том, что импульсная световая стимуляция вызывает синхронную активацию экспрессирующих нейронов, что исключает возможность последовательной активности в стимулируемой популяции. Следовательно, трудно понять, как клетки в пораженной популяции общаются друг с другом или как их фазовые свойства активации связаны с функцией цепи.
Оптогенетическая активация была объединена с функциональной магнитно-резонансной томографией (МРТ) для выяснения коннектома — подробной карты нейронных связей мозга. [89] [92] Точно рассчитанная по времени оптогенетическая активация используется для калибровки отсроченного гемодинамического сигнала ( ЖИРНЫЙ шрифт ), на котором основана фМРТ.
Белки опсины, используемые в настоящее время, имеют пики поглощения во всем видимом спектре, но остаются весьма чувствительными к синему свету. [89] Такое спектральное перекрытие очень затрудняет совмещение активации опсина с генетически закодированными индикаторами ( GEVIs , GECIs , GluSnFR , синапто-pHluorin ), большинство из которых нуждаются в возбуждении синим светом. Опсины с инфракрасной активацией при стандартном значении освещенности увеличат проникновение света и повысят разрешение за счет уменьшения рассеяния света.
Из-за рассеяния узкий луч света, стимулирующий нейроны в участке нервной ткани, может вызвать профиль ответа, который намного шире, чем луч стимуляции. [93] В этом случае нейроны могут активироваться (или тормозиться) непреднамеренно. Инструменты компьютерного моделирования [94] [95] используются для оценки объема стимулируемой ткани для различных длин волн света.
Область оптогенетики продвинула фундаментальное научное понимание того, как определенные типы клеток способствуют функционированию биологических тканей, таких как нервные цепи, in vivo . С клинической точки зрения исследования, основанные на оптогенетике, привели к пониманию болезни Паркинсона и других неврологических и психиатрических расстройств, таких как аутизм , шизофрения , злоупотребление наркотиками , тревога и депрессия . Экспериментальное лечение слепоты включает в себя канал родопсина, экспрессируемый в ганглиозных клетках , который стимулируется световыми узорами из специально разработанных очков.
Оптогенетическая активация обонятельных сенсорных нейронов имела решающее значение для демонстрации времени обработки запаха [107] и механизма нейромодуляторно-опосредованного обонятельного поведения (например , агрессия , спаривание ) . Кроме того, с помощью оптогенетики были воспроизведены данные, показывающие, что что «остаточное изображение» запахов концентрируется в центре вокруг обонятельной луковицы, а не на периферии, где расположены нейроны обонятельных рецепторов. Трансгенных мышей, инфицированных канальным родопсином Thy1-ChR2, стимулировали лазером с длиной волны 473 нм, транскраниально расположенным над дорсальным отделом обонятельной луковицы. Более длительная фотостимуляция митральных клеток в обонятельной луковице привела к наблюдениям более продолжительной активности нейронов в этой области после прекращения фотостимуляции, а это означает, что обонятельная сенсорная система способна претерпевать долгосрочные изменения и распознавать различия между старыми и новыми запахами.
Оптогенетика, свободно движущееся поведение млекопитающих, электрофизиология in vivo и физиология срезов были интегрированы для исследования холинергических интернейронов прилежащего ядра путем прямого возбуждения или торможения. Несмотря на то, что эти холинергические клетки составляют менее 1% от общей популяции прилежащих нейронов, они способны контролировать активность дофаминергических терминалей , которые иннервируют средние шипиковые нейроны (MSN) в прилежащем ядре. Известно, что эти прилежащие MSN участвуют в нервных путях , через которые кокаин оказывает свое воздействие, поскольку было показано, что уменьшение вызванных кокаином изменений в активности этих нейронов ингибирует кокаиновое кондиционирование . Немногочисленные холинергические нейроны, присутствующие в прилежащем ядре, могут оказаться жизнеспособными мишенями для фармакотерапии при лечении кокаиновой зависимости.

Клетки для крыс, оснащенные оптогенетическими светодиодными коммутаторами, позволяющими in vivo изучать поведение животных во время оптогенетических стимуляций.
Записи in vivo и in vitro из Университета Колорадо, Лаборатории оптофизиологии Боулдера, доктора философии Дональда К. Купера. показаны отдельные пирамидальные нейроны , экспрессирующие CAMKII AAV-ChR2 , в префронтальной коре головного мозга, которые продемонстрировали высокую точность вывода потенциала действия с помощью коротких импульсов синего света с частотой 20 Гц ( рис. 1 ). [57]
Моторная кора
Повторная оптогенетическая стимуляция in vivo у здоровых животных могла в конечном итоге вызвать судороги. [111] Эта модель получила название оптокиндлинг.
Грушевидная кора
Повторная оптогенетическая стимуляция пирамидных клеток грушевидной коры in vivo у здоровых животных могла в конечном итоге вызвать судороги. [112] Исследования in vitro выявили потерю торможения по обратной связи в грушевидной цепи из-за нарушения синтеза ГАМК.
Оптогенетика была применена к предсердным кардиомиоцитам , чтобы остановить спирально-волновые аритмии , возникающие при фибрилляции предсердий , с помощью света. [113] Этот метод все еще находится на стадии разработки. Недавнее исследование изучало возможности оптогенетики как метода коррекции аритмий и ресинхронизации кардиостимуляции. В ходе исследования каналродопсин-2 был введен в кардиомиоциты желудочковых областей сердца трансгенных мышей и проведены исследования фотостимуляции in vitro на мышах как с открытой, так и с закрытой полостью. Фотостимуляция привела к усилению активации клеток и, таким образом, к усилению сокращений желудочков, что привело к увеличению частоты сердечных сокращений. Кроме того, этот подход был применен в сердечной ресинхронизирующей терапии ( СРТ ) в качестве нового биологического водителя ритма в качестве замены электродной ЭЛТ. [114] В последнее время оптогенетика стала использоваться в сердце для дефибрилляции желудочковых аритмий с помощью локального эпикардиального освещения, [115] генерализованного освещения всего сердца [116] или индивидуальных схем стимуляции, основанных на аритмогенных механизмах, с целью снижения энергии дефибрилляции. [117]
Оптогенетическая стимуляция спирального ганглия у глухих мышей восстановила слуховую активность. [118] Оптогенетическое применение на области улитки позволяет стимулировать или ингибировать клетки спиральных ганглиев (SGN). Кроме того, из-за особенностей потенциалов покоя SGN были использованы различные варианты белка каналородопсин-2, такие как Chronos, [119] CatCh и f-Chrimson. [120] Варианты Chronos и CatCh особенно полезны тем, что они проводят меньше времени в деактивированном состоянии, что позволяет проявлять большую активность при меньшем излучении вспышек синего света. Кроме того, использование специально разработанных каналов с красным смещением, таких как f-Chrimson, позволяет проводить стимуляцию с использованием более длинных волн, что снижает потенциальный риск фототоксичности в долгосрочной перспективе без ущерба для скорости стробирования. [121] В результате светодиод, производящий свет, потребует меньше энергии, и идея кохлеарного протезирования в сочетании с фотостимуляцией станет более осуществимой. [122]
Оптогенетическая стимуляция модифицированного родопсина, возбудимого красным светом (ReaChR), экспрессируемого в двигательном ядре лица, позволила минимально инвазивно активировать мотонейроны , эффективные в управлении движениями усов у мышей. [123] В одном новом исследовании оптогенетика использовалась на дорсальном ядре шва для активации и ингибирования высвобождения дофаминергических веществ в вентральной области покрышки. Для активации трансгенных мышей инфицировали каналродопсином-2 с промотором TH-Cre, а для осуществления ингибирования к промотору TH-Cre добавляли гиперполяризующий опсин NpHR. Результаты показали, что оптическая активация дофаминергических нейронов привела к увеличению социальных взаимодействий, а их торможение уменьшило потребность в общении только после периода изоляции. [124]
Изучение зрительной системы с помощью оптогенетики может оказаться сложной задачей. Действительно, свет, используемый для оптогенетического контроля, может приводить к активации фоторецепторов в результате близости между первичными зрительными цепями и этими фоторецепторами. В этом случае трудно добиться пространственной избирательности (особенно в случае оптической доли мухи). Таким образом, исследование зрительной системы требует спектрального разделения с использованием каналов , которые активируются длинами волн света, отличными от родопсинов , внутри фоторецепторов (пиковая активация при 480 нм для родопсина 1 у дрозофилы ). Смещенный в красную область CsChrimson [125] или бистабильный Channelrhodopsin [126] используются для оптогенетической активации нейронов (т.е. деполяризации ), поскольку оба допускают спектральное разделение. Чтобы добиться молчания нейронов (т.е. гиперполяризации ), в криптофитных водорослях вида Guillardia theta (названных GtACR1) был обнаружен анионный канал родопсин . [127] можно использовать. GtACR1 более чувствителен к свету, чем другие ингибирующие каналы, такие как хлоридные насосы класса галородопсин, и придает сильную проводимость. Поскольку его пик активации (515 нм) близок к пику активации Родопсина 1, необходимо тщательно калибровать оптогенетическое освещение, а также зрительный стимул. Факторами, которые следует учитывать, являются длина волны оптогенетического освещения (возможно, выше, чем пик активации GtACR1), размер стимула (во избежание активации каналов светом стимула) и интенсивность оптогенетического освещения. освещение. Было показано, что GtACR1 может быть полезным ингибирующим инструментом в оптогенетическом исследовании зрительной системы дрозофилы путем подавления экспрессии нейронов T4/T5. [128] Эти исследования также можно проводить на интактных животных с хорошим поведением, например, для исследования оптомоторной реакции .
Оптогенетическое торможение или активация нейронов проверяет их необходимость и достаточность соответственно для формирования поведения. [129] Используя этот подход, исследователи могут проанализировать нейронные схемы, контролирующие двигательную активность. Возмущая нейроны в различных местах сенсомоторной системы, исследователи узнали о роли нисходящих нейронов в возникновении стереотипного поведения, [130] о том, как локализованный тактильный сенсорный вход [131] и активность промежуточных нейронов [132] изменяют локомоцию, а также о роли Клетки Пуркинье в генерации и модуляции движения. [133] Это мощный метод для более широкого понимания нейронных основ передвижения и движения животных .
Доступные в настоящее время оптогенетические приводы позволяют осуществлять точный временной контроль необходимого вмешательства (т.е. торможения или возбуждения целевых нейронов) с точностью, обычно достигающей миллисекундного уровня. [134] Однако временная точность варьируется в зависимости от оптогенетических актуаторов [135] и зависит от частоты и интенсивности стимуляции. [93]
Теперь можно разработать эксперименты, в которых свет, используемый для вмешательства, инициируется определенным элементом поведения (чтобы подавить поведение), определенным безусловным стимулом (чтобы связать что-то с этим стимулом) или определенным колебательным событием в мозге (чтобы подавить событие). Подобный подход уже использовался в нескольких областях мозга:
Острые волны и комплексы пульсаций (КСВ) представляют собой отдельные высокочастотные колебательные явления в гиппокампе , которые, как полагают, играют роль в формировании и консолидации памяти. Эти события можно легко обнаружить, проследив за колебательными циклами записанного в режиме онлайн локального потенциала поля . Таким образом, начало события можно использовать в качестве триггерного сигнала для световой вспышки, которая направляется обратно в гиппокамп для торможения нейронов, особенно во время КСВ, а также для оптогенетического подавления самих колебаний. [138] Подобные эксперименты с «замкнутым контуром» полезны для изучения комплексов SWR и их роли в памяти.
Оптогенетический контроль клеточных сил и индукция механотрансдукции. [139] Изображенные клетки получают изображение в течение часа одновременно с синим светом, который пульсирует каждые 60 секунд. На это также указывает мигание синей точки на изображении. Клетка расслабляется в течение часа без световой активации, а затем этот цикл повторяется снова. Квадратная вставка увеличивает ядро клетки.
Аналогично тому, как естественные светозависимые ионные каналы, такие как каналродопсин-2, обеспечивают оптический контроль потока ионов, что особенно полезно в нейронауке, естественные светорегулируемые белки передачи сигнала также позволяют оптический контроль биохимических путей, включая как генерацию вторых посланников, так и белок-белковые взаимодействия, что особенно полезно при изучении клеточной биологии и биологии развития. [140] В 2002 году был продемонстрирован первый пример использования фотобелков из другого организма для контроля биохимического пути с использованием светоиндуцированного взаимодействия между растительным фитохромом и фактором взаимодействия с фитохромом (PIF) для контроля транскрипции генов в дрожжах. Путем слияния фитохрома с ДНК-связывающим доменом и PIF с доменом активации транскрипции, активация транскрипции генов, распознаваемых ДНК-связывающим доменом, может быть индуцирована светом. Это исследование предвосхитило аспекты более позднего развития оптогенетики в мозге, например, предположив, что «направленная доставка света с помощью оптоволокна потенциально может воздействовать на выбранные клетки или ткани даже внутри более крупных и непрозрачных организмов». В литературе противоречивы относительно того, следует ли включать контроль клеточной биохимии с помощью фотопротеинов в определение оптогенетики, поскольку в обычном использовании оптогенетика относится конкретно к контролю возбуждения нейронов с помощью опсинов, и как контроль возбуждения нейронов с помощью опсинов постдатируется и использует механизмы, отличные от контроля клеточной биохимии с помощью фотопротеинов. [140]
В дополнение к фитохромам, которые обнаружены в растениях и цианобактериях, домены LOV ( домен свето-кислородного напряжения ) растений и дрожжей и криптохромные домены растений представляют собой другие природные фотосенсорные домены, которые используются для оптического контроля биохимических путей в организме. клетки. Кроме того, на основе флуоресцентного белка Dronpa был создан синтетический фотосенсорный домен для оптического контроля биохимических путей. В фотосенсорных доменах поглощение света связано либо с изменением белок-белковых взаимодействий (в случае фитохромов, некоторых LOV-доменов, криптохромов и мутантов Dronpa), либо с конформационным изменением, которое обнажает связанный сегмент белка или изменяет активность связанного белкового домена (в случае фитохромов и некоторых LOV-доменов). [140] Светорегулируемые межбелковые взаимодействия затем можно использовать для привлечения белков к ДНК, например, для индукции транскрипции генов или модификаций ДНК, или к плазматической мембране, например, для активации резидентных сигнальных белков.CRY2 также кластеризуется, когда активен, поэтому он был слит с сигнальными доменами и впоследствии фотоактивирован, чтобы обеспечить активацию на основе кластеризации. [150] Домен LOV2 Avena sativa (овсяный обыкновенный) использовался для экспонирования коротких пептидов или активного белкового домена светозависимым способом. Введение этого домена LOV в другой белок может регулировать функцию посредством индуцированного светом пептидного нарушения. [154] Белок asLOV2, который оптогенетически экспонирует пептид, также использовался в качестве каркаса для нескольких синтетических систем светоиндуцированной димеризации и светоиндуцированной диссоциации (iLID и LOVTRAP, соответственно). [155] [156] Системы можно использовать для контроля белков посредством стратегии расщепления белков. [157] Фотодиссоциируемые домены Dronpa также использовались для фиксации активного сайта белка в темноте, освобождения его после освещения голубым светом и повторного захвата после освещения фиолетовым светом. [158]
Способность оптически управлять сигналами в течение различной продолжительности времени исследуется, чтобы выяснить, как клеточные сигнальные пути преобразуют длительность сигнала и реакцию на различные выходные сигналы. [ Естественные сигнальные каскады способны реагировать разными выходами на различия в продолжительности и динамике стимула. [160] Например, обработка клеток PC12 эпидермальным фактором роста (EGF, индуцирующим временный профиль активности ERK) приводит к клеточной пролиферации, тогда как введение фактора роста нервов (NGF, индуцирующего устойчивый профиль активности ERK) приводит к дифференцировке в нейроны. -подобные клетки. [161] Первоначально такое поведение было охарактеризовано с использованием приложений EGF и NGF, но результаты были частично воспроизведены с использованием оптических входов. [162] Кроме того, с помощью пульсирующей активации фотопереключаемого RAF, сконструированного с помощью фотодиссоциируемых доменов Dronpa, была обнаружена петля быстрой отрицательной обратной связи в пути RAF-MEK-ERK. [158]
Исследовательская группа профессора Элиаса Манхарреса представила оптогенетическую шумовую фотостимуляцию. Это метод, который использует случайный шумный свет для активации нейронов, экспрессирующих ChR2. Оптимальный уровень опто-шумовой фотостимуляции головного мозга позволяет увеличить потенциалы соматосенсорных вызванных полей, частотную характеристику импульсных нейронов пирамидных нейронов на соматосенсорную стимуляцию и амплитуду натриевого тока.
Комментарии
Оставить комментарий
Квантовая биология
Термины: Квантовая биология